��Ŀ����
����Ŀ��Ϊ̽����ϩ����ļӳɷ�Ӧ����ͬѧ��Ʋ�����������ʵ�飺�����Ҵ���Ũ����Ϊԭ����ȡ��ϩ�������ɵ�����ֱ��ͨ����ˮ�У�������Һ��ɫ����֤����ϩ����ˮ�����˼ӳɷ�Ӧ����ͬѧ�����ڼ�ͬѧ��ʵ���У������������д̼�����ζ���Ʋ����Ƶõ���ϩ�л����ܺ�������Ũ����Ļ�ԭ�������壬�ɴ�����������ȳ�ȥ֮��������ˮ��Ӧ������ش��������⣺
��l����ͬѧ�Ʋ����ϩ�бض����е�һ���������壬������ˮ��Ӧ�Ļ�ѧ����ʽ��_______������֤�����б���ȫ����ȥ��Ϊ����ͬѧ�������ͼ��ʾ��ʵ��װ�á���ش�
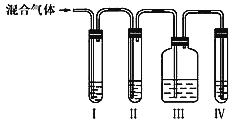
�� I����װ�ÿ�ʢ�ŵ��Լ���I______����______����______����______����ѡ����ţ���
A.Ʒ����Һ B. NaOH��Һ C��Ũ���� D.����KMnO4��Һ
�� ����Ƶ�ʵ������ȷ����������ϩ��������_____________��
��2��Ϊ��֤��ϩ����ķ�Ӧ�Ǽӳɷ�Ӧ������ȡ����Ӧ����ͬѧ����ɽ������ҳ��Ӻ������ͨ����ˮ�У���pH��ֽ�ⷴӦ����Һ������ԣ�����Ϊ�Ƿ����______�������������������������___________________��
��3�������У����˶�Ա������˻�Ť��ʱ����ҽ�漴����Ա�����˲�λ����ҩ�������飨�е�12.27�棩�����оֲ��䶳����Ӧ��������Ҫ�õ��ϴ�����������Ӧ���õ���ȡ������[�û�ѧ��Ӧ����ʽ���л����ýṹ��ʽ��ʾ��]___________���÷�Ӧ��������______��Ӧ�������������������䶳����Ӧ�������ľ�������______________��
���𰸡� SO2 +Br2 + 2H2O = H2SO4+2HBr A B A D III ��Ʒ����Һ����ɫ�� IV�����Ը��������Һ��ɫ�� ���� ������ȡ����Ӧ�������� HBr��ʹ��Һ���Գ����ԡ� CH2=CH2+HCl�� CH3CH2Cl �ӳɷ�Ӧ �е�ͣ�����������
�����������⿼��ʵ�鷽����������ۣ���1����ΪŨ���������ˮ�ԣ����Ҵ�̼����Ȼ������Ũ����������ԣ���̼������ӦC��2H2SO4=CO2����2SO2����H2O��SO2��ʹ��ˮ��ɫ������SO2��Br2��2H2O=H2SO4��2HBr������֤SO2�Ĵ��ڣ�һ����Ʒ����Һ��Ʒ����Һ��ɫ��˵������SO2����ΪSO2�������������NaOH��Һ��ȥ��Ȼ������Ʒ����Һ��֤SO2�Ƿ���������ͨ����������Һ�У���������Լ���˳����A��B��A��D����������III ��Ʒ����Һ����ɫ�� IV�����Ը��������Һ��ɫ����2���������ȡ����Ӧ������HBr��HBr��ˮ��Һ�����ԣ��ӳɷ�Ӧֻ����CH2Br��CH2Br����˱�ͬѧ������Ǻ����ģ���3����ȡ���������飬�������������������ȡ����Ӧ����Ϊ���������������ʽ϶࣬Ӧ��CH2=CH2��HCl�����ӳɷ�Ӧ����Ӧ����ʽΪCH2=CH2��HCl��CH3CH2Cl��������ķе���12.27�棬�е�ϵͣ�Һ��ת�������壬��Ҫ�����������������˴ﵽ�䶳������Ч����

 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�����Ŀ����ѧ��Ӧ����H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ������һЩ��ѧ���ļ��ܣ����ݼ������ݹ��㷴ӦCH4��g��+4F2��g��=CF4��g��+4HF��g���ķ�Ӧ����HΪ����������
��ѧ�� | C��H | C��F | H��F | F��F |
����/��kJmol��1�� | 414 | 489 | 565 | 155 |
A. +485 kJmol��1 B. ��485 kJmol��1
C. +1940 kJmol��1 D. ��1940 kJmol��1