题目内容
【题目】五种短周期元素A、B、D、E、G的原子序数依次增大,其中A、G同主族, B、D、E同周期。A分别与B、E、G形成原子个数比为1:1的化合物甲、乙、丙,它们在 常温常压下分别为气体、液体、固体,甲燃烧时火焰明亮且产生浓烈的黑烟,丙为离子晶体。
(1)D的基态原子有______个未成对电子,甲的电子式为____________
(2)丙与水剧烈反应生成强碱X和A的单质,其化学方程式为______。
(3)乙的水溶液显弱酸性,它在水中的电离方程式为______。
(4)B、E两种元素按原子个数比1:2形成化合物Y,当X与Y按物质的量之比为2:1 完全反应后,所得溶液浓度为0.1 mol/L,其中各离子浓度从大到小的顺序排列为______。
(5)在25°C、10lkPa时,16.0g液态D2A4在氧气中完全燃烧放出热量312 kJ,生成两 种无污染物质,其中一种为单质,另一种是氧化物。写出该反应的热化学方程式______。
【答案】 3 H∶C![]() C∶H NaH+H2O==NaOH+H2↑ H2O2
C∶H NaH+H2O==NaOH+H2↑ H2O2![]() H++HO
H++HO![]() c(Na+)>c(CO
c(Na+)>c(CO![]() )>c(OH-)>c(HCO
)>c(OH-)>c(HCO![]() )>c(H+) N2H4(l)+O2(g)=== N2(g)+2H2O(l) ΔH=-624 kJ·mol-1
)>c(H+) N2H4(l)+O2(g)=== N2(g)+2H2O(l) ΔH=-624 kJ·mol-1
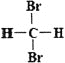
【解析】甲燃烧时火焰明亮且产生浓烈的黑烟,可能是C2H2,A为H元素,B为C元素,A分别与B、E、G形成原子个数比为1:1的化合物甲、乙、丙,它们在 常温常压下分别为气体、液体、固体,乙为H2O2,E为O元素,其中A、G同主族,G为Na元素,丙为NaH,离子晶体。五种短周期元素A、B、D、E、G的原子序数依次增大,A-H、B―C、D―N 、E-O、G-Na。
(1)D是N,它的基态原子有3个末成对电子,甲是C2H2,它的电子式为H∶C![]() C∶H;(2)丙为NaH与水剧烈反应生成强碱X为NaOH和A的单质H2,反应为NaH+H2O==NaOH+H2↑,(3)乙是H2O2,它的水溶液显弱酸性,电离方程式为H2O2
C∶H;(2)丙为NaH与水剧烈反应生成强碱X为NaOH和A的单质H2,反应为NaH+H2O==NaOH+H2↑,(3)乙是H2O2,它的水溶液显弱酸性,电离方程式为H2O2![]() H++HO
H++HO![]() ;(4)B、E两种元素按原子个数比1:2形成化合物Y为CO2,当X与Y按物质的量之比为2:1 完全反应后,所得溶液浓度为0.1 mol/,即生成Na2CO3溶液,碳酸钠溶液中,Na2CO3=2Na++CO32―,碳酸根离子部分水解,CO32―+H2O
;(4)B、E两种元素按原子个数比1:2形成化合物Y为CO2,当X与Y按物质的量之比为2:1 完全反应后,所得溶液浓度为0.1 mol/,即生成Na2CO3溶液,碳酸钠溶液中,Na2CO3=2Na++CO32―,碳酸根离子部分水解,CO32―+H2O![]() HCO3―+OH― ,HCO3―+H2O
HCO3―+OH― ,HCO3―+H2O![]() H2CO3+OH― 溶液显示碱性,由于水中含有水电离的氢氧根离子,c(OH-)>c(HCO3-),故c(Na+)>c(CO
H2CO3+OH― 溶液显示碱性,由于水中含有水电离的氢氧根离子,c(OH-)>c(HCO3-),故c(Na+)>c(CO![]() )>c(OH-)>c(HCO
)>c(OH-)>c(HCO![]() )>c(H+);(5)D2A4为N2H4,相对分子质量为32,故1molN2H4燃烧放出的热量为312 kJ×32g/mol/16g=624 kJ·mol-1,热化学方程式N2H4(l)+O2(g)=== N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。
)>c(H+);(5)D2A4为N2H4,相对分子质量为32,故1molN2H4燃烧放出的热量为312 kJ×32g/mol/16g=624 kJ·mol-1,热化学方程式N2H4(l)+O2(g)=== N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。