题目内容
【题目】某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下。
[实验目的] 测量锌和稀硫酸反应的速率。
[实验用品] 锥形瓶、双孔塞、分液漏斗、直角导管、50 mL注射器、铁架台、秒表、锌粒、1 mol·L-1的H2SO4、4 mol·L-1的H2SO4。
[实验步骤]
(1)甲同学取一套如图装置,加入40 mL 1 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。

(2)乙同学取另一套同样的装置,加入40 mL 4 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
回答下列问题:
(1)Zn与稀H2SO4反应的离子方程式为________。
(2)收集10 mL H2所需时间:甲________(填“大于”“小于”或“等于”)乙。反应速率:甲________(填“大于”“小于”或“等于”)乙。
(3)下列说法正确的是________(填字母)。
A 本实验中甲、乙两同学所用锌粒的表面积要相同
B 装置气密性要好
C 40 mL的H2SO4要迅速加入
D 测量气体体积还可以用排水法
E 若用98%的浓H2SO4,则反应最快
(4)测定Zn和稀H2SO4反应的速率还可用的方法有:①___________; ②_________。
【答案】Zn+2H+=Zn2++H2↑ 大于 小于 ABCD 测定等质量的Zn完全溶解所需要的时间 单位时间内H2SO4浓度的变化
【解析】
(1)金属活动顺序表中排在氢前面的金属可从非强氧化性酸中置换出氢,金属锌可以和硫酸反应生成硫酸锌和氢气,据此书写离子方程式;
(2)浓度越大,反应速率越快,反应产生等量的气体需要的时间越短;
(3)A.研究浓度对反应速率的影响,本实验中所用锌粒的表面积要相同,根据控制变量法来回答;
B.根据测量收集10mL H2所需的时间,要求生成的氢气体积测定必须准确;
C.40mL的H2SO4要迅速加入,防止气体的体积测定误差的出现;
D.氢气的收集可以用排水法收集;
E.若用98%的浓H2SO4,金属和浓硫酸的反应产物是二氧化硫,不是氢气;
(4)可通过测定测量等质量的Zn完全溶解所需要的时间、单位时间内H2SO4浓度的变化、收集等体积H2需要的时间长短等角度判断。
(1)金属锌在金属活动顺序表中排在氢的前面,可以和硫酸反应生成硫酸锌和氢气,离子方程式为:Zn+2H+=Zn2++H2↑;
(2)1molL-1的H2SO4浓度小于4molL-1的H2SO4的,浓度越大,反应速率越快,反应产生等量的气体需要的时间越短;
(3)A.研究浓度对反应速率的影响,本实验中所用锌粒的表面积要相同,故A正确;
B.根据测量收集10mL H2所需的时间,要求生成的氢气体积测定必须准确,气密性必须好,故B正确;
C.40mL的H2SO4要迅速加入,防止气体的体积测定误差的出现,故C正确;
D.氢气不溶于水,收集可以用排水法收集,故D正确;
E.若用98%的浓H2SO4,金属和浓硫酸的反应产物是二氧化硫,不是氢气,故E错误;
故答案为:ABCD;
(4)测定Zn和稀H2SO4反应的速率,测定反应物的变化,可通过测量等质量的Zn完全溶解所需要的时间; 单位时间内H2SO4浓度的变化,测定生成物,可通过收集等体积H2需要的时间长短。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) ![]() 2G(g)。平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。平衡时G的体积分数(%)随温度和压强的变化如下表所示:
温度/体积分数/压强 | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | B |
915 | c | 75.0 | D |
1000 | E | f | 83.0 |
①b<f ②915 ℃、2.0 MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1 000 ℃)>K(810 ℃) 上述①~④中正确的 ( )
A.①②B.②③C.②③④D.①②③④
【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A.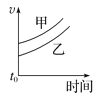 B.
B.
C. D.
D.