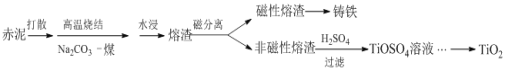
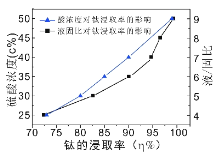
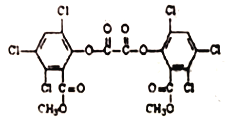
题目内容
【题目】在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2![]() N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
A. ②④ B. ③④ C. ③⑤ D. ①③
【答案】C
【解析】
试题可逆反应2NO2![]() N2O4,正反应为放热反应,升高温度,化学平衡向着逆反应方向移动,①二氧化氮的浓度增大,颜色加深;②混合气体总的物质的量增大,混合气体总的质量不变,根据M=
N2O4,正反应为放热反应,升高温度,化学平衡向着逆反应方向移动,①二氧化氮的浓度增大,颜色加深;②混合气体总的物质的量增大,混合气体总的质量不变,根据M=![]() 可知,混合气体的平均相对分子质量减小;③反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变;④升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大;⑤反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,容器的容积不变,根据ρ=
可知,混合气体的平均相对分子质量减小;③反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变;④升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大;⑤反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,容器的容积不变,根据ρ=![]() 可知,混合气体的密度不变,故选:C。
可知,混合气体的密度不变,故选:C。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | ①_____ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | ②_____ |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____(填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | 15.90 |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。