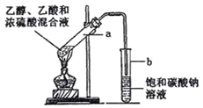
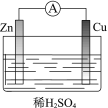
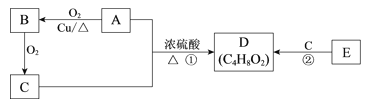
题目内容
【题目】向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是____(用元素符号表示)。
(3)上述深蓝色晶体中含有的元素的电负性最小的是____(用元素符号表示)。
(4)H2O的中心原子轨道杂化类型为____杂化;SO42-离子的立体构型是____,写出与SO42-互为等电子体的一种离子____。
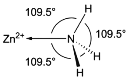
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____。
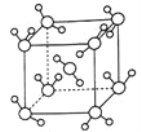
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为____g.cm-3(只列式,不计算)。
【答案】ds 1s22s22p63s23p63d8 N>O>S Cu sp3杂化 正四面体形 PO43-(或ClO4-) 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对间的排斥作用变为成键电子对间的排斥,排斥减弱,故H-N-H键角变大 ![]()
【解析】
(1)根据元素周期表,Cu位于周期表中第4周期第ⅠB族,位于ds区;
铜的核外电子排布式1s22s22p63s23p63d104s1,基态Cu3+失去最外层的三个电子,基态Cu3+的核外电子排布式1s22s22p63s23p63d8,
答案为:ds;1s22s22p63s23p63d8;
(2)N、O位于同一周期,同周期从左到右,第一电离能呈现增大的趋势,但N的最外层电子处于半充满状态,故第一电离能N>O,O、S位于同一主族,同主族从上到下,第一电离能呈减小的趋势,故第一电离能O>S,故第一电离能由大到小的顺序为N>O>S,
故答案为N>O>S;
(3)深蓝色晶体为[Cu(NH3)4]SO4·H2O,含有Cu、N、H、S、O元素,非金属性越弱,电负性越小,则电负性最小的为Cu,
答案为:Cu;
(4)H2O的中心原子是O,根据VSEPR理论,价电子对数为成键电子对+孤电子对数=2+![]() =4根据杂化轨道理论,中心原子O的杂化方式为sp3;深蓝色晶体的阴离子为SO42-,根据VSEPR理论,价电子对数为成键电子对+孤电子对数=4+
=4根据杂化轨道理论,中心原子O的杂化方式为sp3;深蓝色晶体的阴离子为SO42-,根据VSEPR理论,价电子对数为成键电子对+孤电子对数=4+![]() =4,根据杂化轨道理论,中心S的杂化方式为sp3,五个原子构成,则其空间构型为正四面体;等电子体是指在原子数相同下,原子的价电子数相同的粒子,通常采用元素上下左右平移法,同时调电子数来确定等电子体粒子;与SO42-互为等电子体的离子PO43-(或ClO4-)
=4,根据杂化轨道理论,中心S的杂化方式为sp3,五个原子构成,则其空间构型为正四面体;等电子体是指在原子数相同下,原子的价电子数相同的粒子,通常采用元素上下左右平移法,同时调电子数来确定等电子体粒子;与SO42-互为等电子体的离子PO43-(或ClO4-)
故答案为:sp3;正四面体;PO43-(或ClO4-);
(5)中心原子采取不同的杂化形式时,其等性杂化轨道的空间分布情况及杂化轨道之间的夹角是各不相同的。这是决定键角大小的最根本的原因。氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故Zn2+键角变大。
故答案为:氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故Zn2+键角变大。
(6)晶胞中水分子数目=1+8×![]() =2,晶胞质量=
=2,晶胞质量=![]() g,晶体密度ρ=
g,晶体密度ρ=![]()
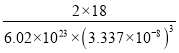 ,
,
答案为: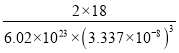 。
。

 快乐5加2金卷系列答案
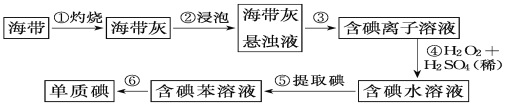
快乐5加2金卷系列答案【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
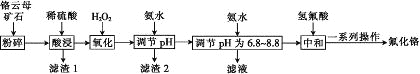
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。