题目内容
短周期元素X、Y、Z、W、R的原子序数依次增大,X单质在暗处与H2剧烈化合并发生爆炸,Y位于第IA族,Z所处的周期序数与族序数相等,W元素最高正价与最低负价之和为0,R与X同族,则
| A.原子半径:Z>Y>X |
| B.X与R的核电荷数相差18 |
| C.气态氢化物稳定性:W>R |
| D.Y与Z两者最高价氧化物对应的水化物能相互反应 |
D
解析试题分析:X单质在暗处与H2剧烈化合并发生爆炸,X为F元素,则Y是Na元素,Z所处的周期序数与族序数相等,应为第三周期第三主族,所以Z是Al元素,W元素最高正价与最低负价之和为0,则W是第四主族元素Si,R与X同族,R是Cl元素。
A、原子半径:X、Y、Z中Na的原子半径最大,错误;B、X与R的核电荷数相差8,错误;C、Cl元素的非金属性强于Si,所以气态氢化物稳定性:W<R,错误;D、氢氧化钠与氢氧化铝可以发生反应,正确,答案选D。
考点:考查元素推断,元素周期律的应用

练习册系列答案
相关题目
运用元素周期律分析下面的推断,其中错误的是( )
| A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 |
| B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm +和Yn - 的核外电
子排布相同,则下列关系式正确的是( )
| A.a = b+m+n | B.a = b-m+n | C.a = b+m-n | D.a=b-m-n |
以下各分子中,所有原子都满足最外层为8电子结构的是 ( )
| A.H3O+ | B.BF3 | C.PCl5 | D.P4O6 |
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是
| A.镭比钙的金属性更强 | B.在化合物中呈+2价 |
| C.镭是一种放射性元素 | D.氢氧化镭呈两性 |
1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是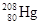 ,它的中子数为:
,它的中子数为:
| A.80 | B.288 | C.208 | D.128 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W | X | |
| | Y | Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性