题目内容
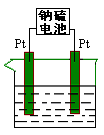
(8分)(1)有一种新型的高能电池—钠硫电池(熔融的钠、硫为两极,以Na+导电的β—Al2O3陶瓷作固体电解质),反应式为:
①充电时,钠极与外电源 极相连。其阳极反应式为: 。
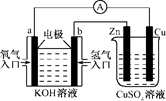
②放电时,发生还原反应的是 极。用该电池作电源电解(如图)分别含有 0.2 mol NaCl和CuSO4的混合溶液500ml时,若此电池工作一段时间后消耗23g Na (电能的损耗忽略不计)。电解后溶液加水稀释至2 L,则溶液的pH为 。
(2)若将钠硫电池改为如图所示的碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出燃料电池的A电极反应式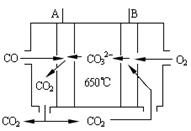

①充电时,钠极与外电源 极相连。其阳极反应式为: 。
②放电时,发生还原反应的是 极。用该电池作电源电解(如图)分别含有 0.2 mol NaCl和CuSO4的混合溶液500ml时,若此电池工作一段时间后消耗23g Na (电能的损耗忽略不计)。电解后溶液加水稀释至2 L,则溶液的pH为 。

(2)若将钠硫电池改为如图所示的碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出燃料电池的A电极反应式

(1)①负极(1分),Na2Sx-2e-=xS+2Na+或Sx2--2e-=xS (2分)②硫或正(1分)。pH = 1(2分) 。
(2)A: CO -2e- + CO3 2―=2CO2 (2分)
(2)A: CO -2e- + CO3 2―=2CO2 (2分)
(1)①放电时钠是负极,所以充电时钠和电源的负极相连。此时阳极反应式为Na2Sx-2e-=xS+2Na+或Sx2--2e-=xS 。
②放电时硫得到电子,时是正极。消耗23g钠,则转移1mol电子。根据电子的得失守恒可知,电解池中生成氯气是0.1mol、铜是0.2mol,所以根据原子守恒可知,生成硫酸是0.1mol,即氢离子是0.2mol,其浓度是0.1mol/L,所以pH=1.
(2)A通入的是CO,作负极,因为CO3 2―向负极移动,所以负极电极反应式为CO -2e- + CO3 2―=2CO2。
②放电时硫得到电子,时是正极。消耗23g钠,则转移1mol电子。根据电子的得失守恒可知,电解池中生成氯气是0.1mol、铜是0.2mol,所以根据原子守恒可知,生成硫酸是0.1mol,即氢离子是0.2mol,其浓度是0.1mol/L,所以pH=1.
(2)A通入的是CO,作负极,因为CO3 2―向负极移动,所以负极电极反应式为CO -2e- + CO3 2―=2CO2。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目