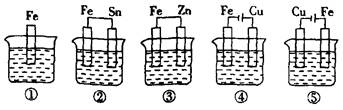
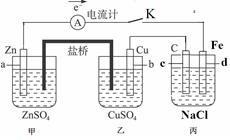
题目内容
(12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
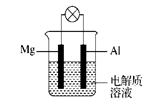
(1)电解质溶液为稀H2SO4时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;若灯泡不亮,其理由为 。
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。
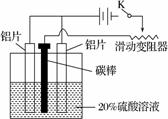
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。

(1)电解质溶液为稀H2SO4时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;若灯泡不亮,其理由为 。
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。

如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。
(12分) (1)亮 负极 硫酸太稀,没有足够的阴、阳离子
(2)亮 负极 电解质中没有足够的阴、阳离子
(3)负极:2Al+3H2O-6e-===Al2O3+6H+
阴极产物为氢气。标准状况下体积为1.12升
(2)亮 负极 电解质中没有足够的阴、阳离子
(3)负极:2Al+3H2O-6e-===Al2O3+6H+
阴极产物为氢气。标准状况下体积为1.12升
(1)形成原电池的条件:活性不同的两个电极、电解质溶液形成闭合回路。
(2)虽然镁的活泼相对铝较强,但它不能和碱液反应,而铝却可与其反应,失电子作负极;
(3)由题意知,铝极失电子形成氧化膜。即:
阳极:2Al+3H2O-6e-===Al2O3+6H+
阴极为:H++2e+=H2↑
可得关系式: 3 H2↑ ~ 3O(两极质量差)
_ 22.4:L 16g
即: 1.12L 0.8g
(2)虽然镁的活泼相对铝较强,但它不能和碱液反应,而铝却可与其反应,失电子作负极;
(3)由题意知,铝极失电子形成氧化膜。即:
阳极:2Al+3H2O-6e-===Al2O3+6H+
阴极为:H++2e+=H2↑
可得关系式: 3 H2↑ ~ 3O(两极质量差)
_ 22.4:L 16g
即: 1.12L 0.8g

练习册系列答案
相关题目