题目内容
已知298K时,2SO2(g)+O2(g)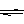 2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
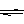 2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )| A.Q1=Q2=197KJ | B.Q1<Q2<197KJ | C.Q2<Q1<197KJ | D.Q1=Q2<197KJ |
C
试题分析:由反应方程式中可以看出,每有2mol的SO2发生反应放出热量为197KJ.但由于该反应是可逆反应,当向密闭容器中通入2molSO2和1molO2时不可能反应完全,所以放出热量要小于197KJ.当向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,就相当与只加入1molSO2、0.5molO2。由于减小反应物浓度,化学平衡逆向移动,放热比第一种情况还少。所以关系式正确的是Q2<Q1<197KJ 。选项为:C。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
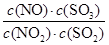 。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( ) NO(g)+SO3(g) ΔH>0
NO(g)+SO3(g) ΔH>0 XC(g)+D(S),向家中通入6molA和2molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测的甲、乙两个容器中的C的体积分数都是0.2,下列叙述中正确的是:
XC(g)+D(S),向家中通入6molA和2molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测的甲、乙两个容器中的C的体积分数都是0.2,下列叙述中正确的是: 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求: zC(g),平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( )
zC(g),平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( ) N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
 CO2(g)+ H2(g) 达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为
CO2(g)+ H2(g) 达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )