��Ŀ����
����Ŀ������ѧ��ѡ��3�����ʽṹ�����ʡ�ͭ����Ҫ�Ĺ���Ԫ�أ��䵥�ʼ���������й㷺��;���ش��������⣺
��1��ͭԪ�ػ�̬ԭ�ӵļ۵����Ų�ʽ________��
��2��ͭ���γɶ���������Cu2�����Ҷ�����H2N-CH2-CH2-NH2�����γ���ͼ��ʾ�����ӡ�

��Cu2�����Ҷ������γɵ��������к��еĻ�ѧ����________��
a����λ�� b�����Ӽ� c�� ![]() �� d��
�� d�� ![]() ��
��
���Ҷ��������е�ԭ�ӵ��ӻ��������Ϊ________��C��N��H����Ԫ�صĵ縺���ɴ�С˳����________��
���Ҷ��������װ�[N(CH3)3]�����ڰ����Ҷ����ķе�����װ��ߺܶ࣬ԭ����________��
��3��Cu2+��ˮ��Һ����[Cu(H2O)4]2+��ʽ���ڣ���Cu2+����Һ�м���������ˮ�������ɸ��ȶ���[Cu(NH3)4]2+����ԭ����________��
��4��Cu��S�γ�ij�־���ľ�����ͼ��ʾ��

�ٸþ���Ļ�ѧʽΪ________��
�ڸþ���ԭ���������AΪ(0��0��0)��BΪ(1��0��0)����Cԭ�ӵ��������Ϊ________��
����֪�þ�����ܶ�Ϊd g��cm��3��Cu2+��S2���İ뾶�ֱ�Ϊa pm��b pm�������ӵ�����ֵΪNA����ʽ��ʾ�þ�����ԭ�ӵĿռ�������________��
���𰸡� 3d104s1 ac sp3 N>C>H �Ҷ������Ӽ���γ������ ���װ����Ӽ䲻���γ���� N Ԫ�ص縺�Ը�С�� �������¶Ե����γ���λ�� CuS ![]()
![]()
����������1��ͭ��29��Ԫ�أ���̬ͭԭ�ӵļ۵����Ų�ʽΪ3d104s1����4����Cu2+���Ҷ����γɵ�������Ϊ![]() ��������֮�������λ�������⣬̼��֮����ڼ��Լ���̼̼֮����ڷǼ��Լ����Ҷ���������N����H��λ�����ۼ���Ϊ��������
��������֮�������λ�������⣬̼��֮����ڼ��Լ���̼̼֮����ڷǼ��Լ����Ҷ���������N����H��λ�����ۼ���Ϊ��������![]() ����������
����������![]() ������ѡac�����Ҷ��������е�ԭ���γ�4���ļ����۲���Ӷ���Ϊ4����ԭ��Ϊsp3�ӻ���C��N��H����Ԫ�أ�������������Խǿ��Ԫ����縺��Խ����������������С˳����N��C��H��������縺�Դ�С˳����N��C��H�����Ҷ��������װ�[N(CH3)3]�����ڰ����Ҷ����ķе�����װ��ߺܶ࣬ԭ�����Ҷ������Ӽ���γ������ ���װ����Ӽ䲻���γ��������3��Cu2+��ˮ��Һ����[Cu(H2O)4]2+��ʽ���ڣ���Cu2+����Һ�м���������ˮ�������ɸ��ȶ���[Cu(NH3)4]2+����ԭ����N Ԫ�ص縺�Ը�С�� �������¶Ե����γ���λ������4���ٸ��ݾ�̯���ɵþ�����Cuԭ�Ӹ���Ϊ
������ѡac�����Ҷ��������е�ԭ���γ�4���ļ����۲���Ӷ���Ϊ4����ԭ��Ϊsp3�ӻ���C��N��H����Ԫ�أ�������������Խǿ��Ԫ����縺��Խ����������������С˳����N��C��H��������縺�Դ�С˳����N��C��H�����Ҷ��������װ�[N(CH3)3]�����ڰ����Ҷ����ķе�����װ��ߺܶ࣬ԭ�����Ҷ������Ӽ���γ������ ���װ����Ӽ䲻���γ��������3��Cu2+��ˮ��Һ����[Cu(H2O)4]2+��ʽ���ڣ���Cu2+����Һ�м���������ˮ�������ɸ��ȶ���[Cu(NH3)4]2+����ԭ����N Ԫ�ص縺�Ը�С�� �������¶Ե����γ���λ������4���ٸ��ݾ�̯���ɵþ�����Cuԭ�Ӹ���Ϊ![]() ��Sԭ�Ӹ���Ϊ4���ʾ���Ļ�ѧʽΪCuS���ڸ��ݸ���ԭ�ӵ����λ�ÿ�֪��D�ڸ��������1/4����������������
��Sԭ�Ӹ���Ϊ4���ʾ���Ļ�ѧʽΪCuS���ڸ��ݸ���ԭ�ӵ����λ�ÿ�֪��D�ڸ��������1/4����������������![]() ������֪�þ�����ܶ�Ϊd g��cm��3��Cu2+��S2���İ뾶�ֱ�Ϊa pm��b pm�������ӵ�����ֵΪNA��һ��������ԭ�ӵ����Ϊ
������֪�þ�����ܶ�Ϊd g��cm��3��Cu2+��S2���İ뾶�ֱ�Ϊa pm��b pm�������ӵ�����ֵΪNA��һ��������ԭ�ӵ����Ϊ![]() ��һ�����������Ϊ
��һ�����������Ϊ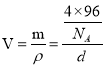 ���ʾ�����ԭ�ӵĿռ�������Ϊ
���ʾ�����ԭ�ӵĿռ�������Ϊ ��
��

 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�