【题目】(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②H2O(g) ═ H2O(l) ΔH2=-44kJ·mol-1
③CH3CH2OH(l)+2O2(g)═2CO(g)+3H2O(l) ΔH3=-932kJ·mol-1
写出CO燃烧热的热化学方程式 ____________。
(2)在图18中画出不同温度下(T1>T2),上述反应③中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。________
(3)一定条件下,在体积为2 L的密闭容器中发生反应:CO(g) + 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①该反应的平衡常数表达式K=__________;根据图19判断,升高温度,平衡常数K值将_____(填“增大”、“减小”或“不变”)。
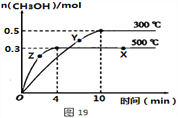
②500℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是____。
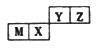
③X点与Y点的平均速率:v(X)____v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)____v逆(Z)(填“>”、“<”、“=”)。
(4)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。
①已知常温时,0.1mol/L的甲酸溶液其pH约为2.4,请用离子反应方程式表示甲酸钠的水溶液呈碱性的原因_________。
②向20mL 0.1mol/L的甲酸钠溶液中小心滴加10mL 0.1mol/L的盐酸,混合液呈酸性,请按由大到小的顺序给溶液中离子浓度排序_________。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案