题目内容
【题目】(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②H2O(g) ═ H2O(l) ΔH2=-44kJ·mol-1
③CH3CH2OH(l)+2O2(g)═2CO(g)+3H2O(l) ΔH3=-932kJ·mol-1
写出CO燃烧热的热化学方程式 ____________。
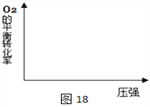
(2)在图18中画出不同温度下(T1>T2),上述反应③中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。________
(3)一定条件下,在体积为2 L的密闭容器中发生反应:CO(g) + 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①该反应的平衡常数表达式K=__________;根据图19判断,升高温度,平衡常数K值将_____(填“增大”、“减小”或“不变”)。
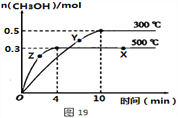
②500℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是____。
③X点与Y点的平均速率:v(X)____v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)____v逆(Z)(填“>”、“<”、“=”)。
(4)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。
①已知常温时,0.1mol/L的甲酸溶液其pH约为2.4,请用离子反应方程式表示甲酸钠的水溶液呈碱性的原因_________。
②向20mL 0.1mol/L的甲酸钠溶液中小心滴加10mL 0.1mol/L的盐酸,混合液呈酸性,请按由大到小的顺序给溶液中离子浓度排序_________。
【答案】 CO(g) +1∕2 O 2 (g)= CO 2 (g) △H =-283kJ·mol-1 
![]() 减小 0.075mol·L-1·min-1 < > HCOO- +H2O
减小 0.075mol·L-1·min-1 < > HCOO- +H2O ![]() HCOOH+ OH- C(Na+)>C(HCOO-)>C(Cl-)>C(H+)>C(OH-)
HCOOH+ OH- C(Na+)>C(HCOO-)>C(Cl-)>C(H+)>C(OH-)
【解析】(1)已知①CH3CH2OH(l)+3O2(g)2CO2(g)+3H2O(g)△H1=-1366kJmol-1,②H2O(g)=H2O(l)△H2=-44kJmol-1,③CH3CH2OH(l)+2O2(g)2CO(g)+3H2O(l)△H3=-932kJmol-1,利用盖斯定理,将①+②×3-③可得2CO(g)+O2(g)=2CO2(g)△H=(-1366kJmol-1)+(-44kJmol-1)×3-(-932kJmol-1)=-566kJmol-1,则CO燃烧热的热化学方程式为CO(g) +![]() O 2 (g)= CO 2 (g) △H =-283kJ·mol-1 ;
O 2 (g)= CO 2 (g) △H =-283kJ·mol-1 ;
(2)对反应CH3CH2OH(l)+2O2(g)═2CO(g)+3H2O(l) ΔH3=-932kJ·mol-1 ,温度越高反应速率越快,但升高温度平衡逆向移动,O2的转化率降低,则相应的图像为 ;
;
(3)①因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,所以K=![]() ,由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小;
,由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小;
②由图象可知,在500℃时,4min到达平衡,甲醇的平均反应速率v(CH3OH)= =0.0375mol(Lmin)-1,由速率之比等于化学计量数之比求出,则v(H2)=2v(CH3OH)=2×0.0375mol(Lmin)-1=0.075mol(Lmin)-1;
=0.0375mol(Lmin)-1,由速率之比等于化学计量数之比求出,则v(H2)=2v(CH3OH)=2×0.0375mol(Lmin)-1=0.075mol(Lmin)-1;
③X点为平衡状态,平均反应速率为0,则X点与Y点的平均速率:v(X)<v(Y);在相同温度下,浓度大反应速率快,X点甲醇的浓度大于Z点,则v正(X)>v逆(Z);
(4)①甲酸钠是强碱弱酸盐,水解呈碱性,所以水溶液呈碱性,离子反应方程式表示其原因HCOO-+H2OHCOOH+OH-;
②向20mL0.1mol/L的甲酸钠溶液中滴加10ml0.1mol/L的盐酸,得到等物质的量浓度的甲酸、甲酸钠和氯化钠的混合液,以甲酸的电离为主,溶液呈酸性,溶液中离子浓度从大到小的顺序为c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-)。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案