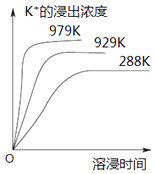
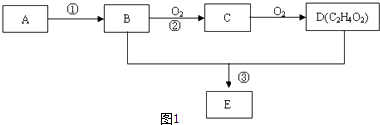
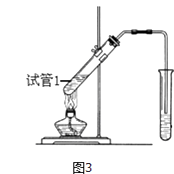
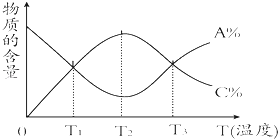
题目内容
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 . a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 , 氧化性最弱的简单阳离子是(填离子符号) .
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
①工业制镁时,电解MgCl2而不电解MgO的原因是
②制铝时,电解Al2O3而不电解AlCl3的原因是; ③写出电解Al2O3反应方程式 .
【答案】
(1)b
(2)氩;Na+
(3)MgO的熔点高,熔融时消耗更多能量,增加生产成本;氯化铝是共价化合物,熔融态氯化铝难导电;2Al2O3(熔融) ![]() +4Al+3O2↑
+4Al+3O2↑
【解析】解:(1)a.第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,从阳离子到阴离子,半径在增大,故a错误; b.同一周期中,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,故b正确;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故c错误;
d.同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故d错误;
所以答案是:b;(2)原子最外层电子书与次外层电子数相同,而第三周期中次外层电子为8,该元素原子结构示意图为 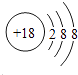 ,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+ ,
,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+ ,
所以答案是:氩;Na+;(3)①由于氧化镁的熔点远远大于氯化镁的熔点,熔融时消耗更多能量,增加生成成本,所以工业制镁时,采用电解MgCl2而不电解MgO,
所以答案是:MgO的熔点高,熔融时消耗更多能量,增加生产成本;
②由于氯化铝为共价化合物,熔融状态下氯化铝难导电,制锅时电解Al2O3而不电解AlCl3 ,
所以答案是:氯化铝是共价化合物,熔融态氯化铝难导电;
③电解氧化铝生成铝和氧气,电解时加入冰晶石以降低熔点,方程式为2Al2O3(熔融) ![]() +4Al+3O2↑,
+4Al+3O2↑,
所以答案是:2Al2O3(熔融) ![]() +4Al+3O2↑.
+4Al+3O2↑.