题目内容
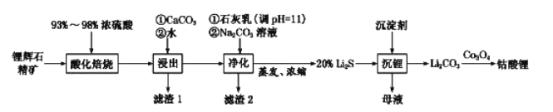
【题目】肼(N2H4)是一种无色、易溶于水和具有强还原性的液体,沸点为113.5℃。广泛应用于医药等领域。工业上利用尿素法生产肼,同时得到副产品Na2CO3·10H2O,其工艺流程如下:

完成下列填空:
制肼过程的反应为:CO(NH2)2 + NaClO + 2NaOH → N2H4 + Na2CO3 + NaCl + H2O。
(1)将Cl2通入水中,所得溶液中具有氧化性的微粒是______________________。
(2)写出I吸收时发生反应的离子方程式__________________________。为保证后续反应充分,理论上需要通入氯气与烧碱溶液的质量之比应为71:____。
(3)已知氯酸钠有一定的氧化性。而在氯气和烧碱反应时,需控制反应温度防止氯酸钠生成。原因是______、____________。
(4)上述流程合成的Na2CO3·10H2O中含有杂质。若要检验杂质的阴离子,选择的试剂是________________________。
(5)Na2CO3·10H2O的纯度可用气体法测定,在一定温度和压强下,还需要测定的物理量___________________。
【答案】Cl2、HClO、ClO- Cl2 + 2OH—=ClO—+ Cl—+ 2H2O 640 次氯酸钠的氧化性强于氯酸钠 节省能源 稀硝酸、硝酸银溶液 反应前固体总质量、气体体积
【解析】
(1)氯气和水反应的方程式为:Cl2+H2O=HClO+HCl,氯水的成分:Cl2、HCl、H2O,H+、Cl﹣、ClO﹣、OH﹣,具有强氧化性的含氯元素的微粒为:Cl2、HClO、ClO﹣,故答案为Cl2、HClO、ClO﹣;
(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式Cl2+2OH﹣=ClO﹣+Cl﹣+2H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160,则通入氯气与烧碱溶液的质量之比应为71:160/0.25=71:640;
(3)次氯酸钠的氧化性强于氯酸钠,温度高时生成氯酸钠,低温可节省能源,故答案为次氯酸钠的氧化性强于氯酸钠;节省能源;
(4)Na2CO310H2O中含有含有氯离子,实验室用硝酸酸化的硝酸银溶液检验氯离子,故答案为稀硝酸、硝酸银溶液;
(5)碳酸钠能与盐酸反应生成二氧化碳,根据二氧化碳的体积能确定碳酸钠的物质的量,然后可求出Na2CO310H2O的纯度,故答案为反应前固体总质量、气体体积。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
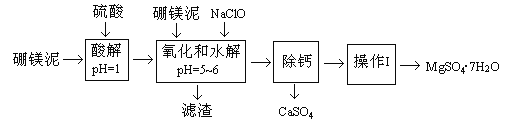
小学生10分钟应用题系列答案【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。