题目内容
【题目】氢氟酸可用于半导体工业,也常用来蚀刻玻璃,其刻蚀反应原理如下:6HF+Na2SiO3→2NaF+SiF4↑+3H2O
完成下列填空:
(1)根据HF的___(选填编号)大于H2O,可推断氟元素的非金属性强于氧元素。
a.酸性 b.熔沸点 c.稳定性 d.键的极性
(2)SiF4与甲烷结构相似,SiF4是含___键的___分子(均选填“极性”或“非极性”)。刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物,该化合物的电子式为___。
(3)Si原子核外电子有___种不同能量的电子,其中最高能量的电子处于___轨道。
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,两个反应原理相似,但前者的反应速率明显大于后者。原因是___。
(5)同浓度的H2SO3和HF两溶液的pH为:H2SO3___HF(选填“>”或“<”)。浓度均为0.01mol/L的H2SO3和HF的1L混合溶液中,通入0.02molNH3充分反应后,SO32-、HSO3-、F-、NH4+浓度从大到小的顺序为:___。
已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7;HF Ki=6.8×10-4;NH3H2O Ki=1.8×10-5。
【答案】cd 极性 非极性 ![]() 5 3p NaF易溶于水,而CaF2难溶于水,会覆盖在固体表面,降低反应速率 < c(NH4+)>c(F-)>c(HSO3-)>c(SO32-)
5 3p NaF易溶于水,而CaF2难溶于水,会覆盖在固体表面,降低反应速率 < c(NH4+)>c(F-)>c(HSO3-)>c(SO32-)
【解析】
(1)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;
(2)由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,分子中正负电荷中心重合,从整个分子来看,电荷的分布是均匀的,对称的,这样的分子为非极性分子,反之为极性分子,甲烷为正四面体结构;一般来说,活泼金属和活泼非金属元素之间易形成离子键,刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物为氢氧化钠,氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合而成,氢和氧两种元素以共价键结合;
(3)原子核外电子是分层排布的,在不同电子层上运动的电子的能量不同,有几个轨道上排布电子,共有几种不同的能量;原子核外电子是分层排布的,距离原子核越近能量越低,反之越高;
(4)接触面积影响化学反应速率;
(5)电离平衡常数越大,酸性越强,亚硫酸为二元弱酸,氢氟酸为一元弱酸,浓度均为0.01mol/L 的H2SO3和HF的1L混合溶液中,通入0.02mol NH3充分反应后,生成等浓度的亚硫酸氢铵、氟化铵,亚硫酸氢根离子水解能力强于氟离子。
(1)通过氢化物的稳定性可以判断非金属性强弱,氢化物的稳定性与键的极性有关,所以符合推断氟元素的非金属性强于氧元素条件的为cd,故答案为:cd;
(2)SiF4中硅原子和氟原子之间以极性共价键结合,SiF4与甲烷结构相似,甲烷为正四面体结构,所以SiF4从整个分子来看,电荷的分布是均匀的,对称的,为非极性分子,刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物为氢氧化钠,其电子式为:![]() ;
;
(3)硅原子为14号元素,电子排布式1s22s22p63s23p2,共有5个轨道上排布电子,所以有5种不同能量的电子,原子核外电子是分层排布的,距离原子核越近能量越低,所以3p能量最高;
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,Na2SiO3与氢氟酸反应生成的NaF易溶于水,而CaSiO3与氢氟酸反应生成的CaF2难溶于水,会覆盖在固体表面,降低反应速率,所以前者的反应速率明显大于后者;
(5)H2SO3 Ki1=1.54×10﹣2大于HF Ki=6.8×10﹣4,所以同浓度,亚硫酸酸性强于氢氟酸,即pH小于氢氟酸,浓度均为0.01mol/L 的H2SO3和HF的1L混合溶液中,通入0.02mol NH3充分反应后,生成等浓度的亚硫酸氢铵、氟化铵,HF Ki=6.8×10﹣4 大于NH3H2O Ki=1.8×10﹣5大于H2SO3 Ki2=1.02×10﹣7,所以亚硫酸氢根离子水解能力强于氟离子,溶液中离子浓度为:c(NH4+)>c(F﹣)>c(HSO3﹣)>c(SO32﹣)。

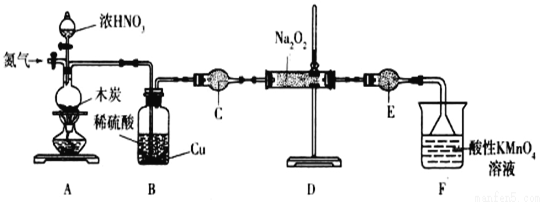
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。