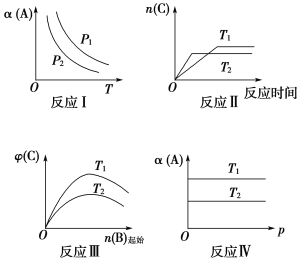
题目内容
【题目】某次实验需用0.4molL﹣1 NaOH溶液480mL.配制方法如下:
(1)用托盘天平准确称量g 固体NaOH;
(2)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待后,将烧杯中的溶液注入容量瓶中;
(3)用少量蒸馏水洗涤烧杯次,洗涤后的溶液 , 轻轻晃动容量瓶,使溶液混合均匀;
(4)向容量瓶中加入蒸馏水,到液面时,改用加蒸馏水至液面最低点与刻度线相切.盖好瓶塞,;
(5)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是 , 偏低的是 , 对实验结果没有影响的是(填各选项的序号). A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
【答案】
(1)8.0
(2)溶液冷却至室温后
(3)2﹣3;一起转入容量瓶中
(4)1~2cm;胶头滴管;上下颠倒混合均匀
(5)ADF;EG;BC
【解析】解:(1)需用0.4molL﹣1 NaOH溶液480mL,因溶液的体积480mL,但容量瓶的规格没有480mL,所以选用500mL容量瓶,需氢氧化钠的质量为m=0.5L×0.4molL﹣1×40g/mol=8.0g;故答案为:8.0;(2)容量瓶不能用于盛放过热或者过冷液体,所以稀释后应冷却到室外再进行移液;故答案为:溶液冷却至室温后;(3)洗涤操作时应用少量蒸馏水洗涤烧杯2﹣3次,洗涤后的溶液一起转入容量瓶中,轻轻晃动容量瓶,使溶液混合均匀;故答案为:2﹣3;一起转入容量瓶中;(4)定容时向容量瓶中加入蒸馏水,到液面1~2cm时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切.盖好瓶塞,上下颠倒混合均匀;故答案为:1~2cm时;胶头滴管;上下颠倒混合均匀;(5)A.Na2O与水反应生成氢氧化钠,62gNa2O可生成NaOH80g,NaOH的质量增大,所以溶液浓度偏高;
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥,不影响氢氧化钠的质量,对溶液浓度无影响;
C.配制溶液所用的容量瓶洗净后没有烘干,对溶液浓度无影响;
D.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏高;
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;
F.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
G.定容摇匀后静止,液面低于刻度线,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
所以偏高的有ADF,偏低有EG,无影响的是BC,
故答案为:ADF;EG;BC.
(1)依据配制溶液体积选择合适容量瓶,依据m=CVM计算需要溶质的质量;(2)容量瓶为精密仪器,不能盛放过热、过冷的液体,只有在室温下标定的体积才准确;(3)为保证溶质全部转移的容量瓶,应将烧杯和玻璃棒洗涤2﹣3次,洗涤液全部转移的容量瓶;(4)定容的正确操作为:开始直接向容量瓶中加蒸馏水,到离刻度线1﹣2cm时,应用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c= ![]() 分析判断.
分析判断.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案