题目内容
【题目】(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应: 2SO2(g)+O2(g)═2SO3(g),此反应放热。2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请填写下列空白:
①从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时,SO2 转化率为 _____
②下列叙述能证明该反应已达到化学平衡状态的是 _________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2 的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为______,发生的电极反应为______;
②电池正极发生的电极反应为______;
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是____,反应的化学方程式为______
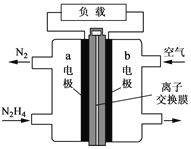
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为 ______ ,正极反应式为 ____
【答案】0.3mol/(Lmin) 60% ABE 锂 Li-e-═Li+ 2SOCl2+4e-=4Cl-+S+SO2 出现白雾,有刺激性气体生成 SOCl2+H2O=SO2↑+2HCl↑ N2H4+4OH--4e-=N2↑+4H2O O2+4e-+2H2O=4OH-
【解析】
(1)①利用“三段式”,根据恒温恒容条件下,压强比等于物质的量比计算达到平衡时SO2浓度的变化量。
②根据平衡标志判断;
(2)①根据电池总反应,4Li+2SOCl2═4LiCl+S+SO2,可知Li失电子发生氧化反应;
②正极反应式可由总反应减去负极反应式得到;
③把少量水滴到SOCl2中,发生水解反应生成二氧化硫和氯化氢;
(3)b极通入空气,则氧气发生还原反应,作原电池的正极,N2H4在a极发生氧化反应,生成氮气和水;
(1)①
2SO2(g)+O2(g)═2SO3(g)
开始 1 0.5 0
转化 2x x 2x
平衡 1-2x 0.5-x 2x
恒温恒容条件下,压强比等于物质的量比,则![]() ,x=0.3。从反应开始到达化学平衡,生成SO3的平均反应速率为
,x=0.3。从反应开始到达化学平衡,生成SO3的平均反应速率为![]() 0.3mol/(Lmin);平衡时,SO2 转化率为
0.3mol/(Lmin);平衡时,SO2 转化率为![]() 60%;
60%;
②A.反应前后气体物质的量改变,恒温恒容条件下,压强是变量,容器内压强不再发生变化时,一定达到平衡状态,故选A;
B.根据化学平衡的定义,SO2的体积分数不再发生变化,一定达到平衡状态,故选B;
C.化学变化中,原子数是恒量,容器内气体原子总数不再发生变化,不一定平衡,故不选C;
D.相同时间内消耗2nmolSO2的同时消耗nmolO2 ,都是指正反应速率,不一定平衡,故不选D;
E.相同时间内消耗2nmolSO2 的同时生成nmolO2 ,正逆反应速率比等于系数比,一定达到平衡状态,故选E;
F.反应前后气体质量不变,恒温恒容条件下,密度是恒量,混合气体密度不再变化,不一定平衡,故不选F。
(2)①根据电池总反应,4Li+2SOCl2═4LiCl+S+SO2,可知Li失电子发生氧化反应,Li是负极,负极反应式是Li-e-═Li+;
②总反应减去负极反应式得正极反应式2SOCl2+4e-=4Cl-+S+SO2;
③把少量水滴到SOCl2中,发生水解反应生成二氧化硫和氯化氢,现象是出现白雾,有刺激性气体生成,反应方程式是SOCl2+H2O=SO2↑+2HCl↑;
(3)b极通入空气,则氧气发生还原反应生成氢氧根离子,作原电池的正极,正极反应式为O2+4e-+2H2O=4OH-,N2H4在a极发生氧化反应,生成氮气和水;a为负极,负极反应式为N2H4+4OH--4e-=N2↑+4H2O。

【题目】用下列实验装置进行相应的实验,不能达到实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
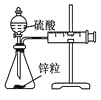
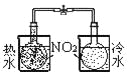
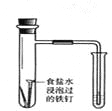
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A. A B. B C. C D. D