题目内容
下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )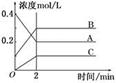
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
C
解析试题分析:A.根据图示可知:A是反应物,B、C是生成物。错误。 B.在前2 min A的分解速率(0.4mol/L -0.2mol/L)÷2min=" 0.1" mol·L-1·min-1.错误。C.在前2 min C的生成速率为(0.2 mol/L- 0mol/L) ÷2min = 0.1mol/(L·min).正确。D.在反应中各种物质的浓度的变化关系是:A:0.2mol/L;B: 0.2mol/L;;C:0.1 mol/L.在相同时间内,物质的浓度变化的比对于方程式该物质前边的计量数的比。所以反应的方程式为:2A(g) 2B(g)+C(g)。错误。
2B(g)+C(g)。错误。
考点:考查可逆发生的反应物、生成物、方程式的确定及化学反应速率的计算的知识。

对于可逆反应mA(g) + nB(g)  pC(g) + qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是( )
pC(g) + qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是( )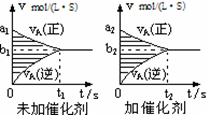
| A.b1>b2 ,t1>t2 |
| B.两图中阴影部分面积一定相等 |
| C.A的平衡转化率(II)大于(Ⅰ)中A的转化率 |
| D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A.v(CO)=1.5 mol·L-1·min-1 | B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 | D.v(CO2)=1.1 mol·L-1·min-1 |
已知:3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示: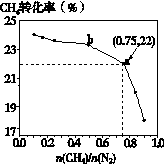
下列说法正确的是
| A.n(CH4)/n(N2)越大,CH4的转化率越高 |
| B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 |
| C.b点对应的平衡常数比a点的大 |
| D.a点对应的NH3的体积分数约为26% |
mA(g)+nB(g) 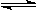 pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
①体系的压强不再改变 ②绝热体系的温度不再改变 ③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率vA: vB: vC: vD = m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
| A.③④⑤⑥ | B.②③④⑥ | C.①③④⑤ | D.①③④⑥ |
如图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )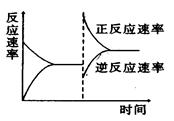
| A.升高温度,同时加压 | B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 | D.增大反应物浓度,同时使用催化剂 |
X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
A. ×100% ×100% | B. ×100% ×100% | C. ×100% ×100% | D. ×100% ×100% |
CO(g)+H2O(g)  ?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
| A.加入催化剂,加快了反应速率,反应的ΔH也随之改变 |
| B.温度降低,正、逆反应速率都减小,反应放出的热量不变 |
| C.恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
| D.改变压强,反应速率发生改变,反应放出的热量不变 |
 2C(g),下列各数据表示同一反应速率是
2C(g),下列各数据表示同一反应速率是