题目内容
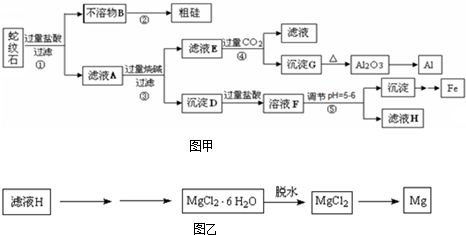
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
请回答下列问题:
(1)操作①的名称
(2)检验溶液Ⅱ中是否含有Fe3+的方程式 (最优方法)
(3)沉淀A与萤石(CaF2)在硫酸酸化下可以制备石膏,写出反应方程式
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为
(5)操作②中应控制溶液pH的合理范围是
A.小于1.5B.1.5~3.3 C.7~8 D.大于9.4
(6)为探究所得的水合碱式碳酸镁[xMgCO3?yMg(OH)2?zH2O]的组成,取样18.2g g于装置A的玻璃管中,请按由左-→右顺序将下列装置连接好(如图乙)(填序号,装置可重复使用):
(2)依据流程图分析溶液Ⅰ主要是氯化镁、氯化铝、氯化铁的溶液;加入氢氧化钙得到溶液Ⅱ是否含有三价铁离子的检验方法是加入硫氰酸钾后,溶液变血红色;
(3)沉淀A判断为SiO2;与萤石(CaF2)在硫酸酸化下可以制备石膏硫酸钙,可以理解为浓硫酸和氟化钙反应生成氢氟酸和硫酸钙,氢氟酸和二氧化硅反应生成四氟化硅和水;依据化学反应的原子守恒配平写出化学方程式;
(4)依据转化关系分析,过程为了制备碳酸镁,所以操作2氢氧化钙需要适量,控制溶液pH小于9.4,不能沉淀镁离子,且使铝离子和铁离子全部生成沉淀,判断沉淀B为氢氧化铝、氢氧化铁,得到红色氧化物,需要加入过量氢氧化钠溶液溶解氢氧化铝为偏铝酸钠溶液,过滤得到氢氧化铁沉淀,加热得到氧化铁;
(5)操作②是控制溶液PH,使铁离子和铝离子沉淀,镁离子不沉淀,控制溶液pH小于9.4,但不能使氢氧化铝溶解;
(6)利用水合碱式碳酸镁[xMgCO3?yMg(OH)2?zH2O]的组成,分析判断实验装置的应用,测定分解产物中的水,二氧化碳,固体质量分别计算得到,加热分解得到固体为氧化镁;要求加热分解环境不含水、二氧化碳;测定装置不能和空气相连;依据质量守恒、元素守恒,结合测定质量计算得到x、y、z.
(2)三价铁离子的检验方法为加入无色溶液硫氰酸钾,溶液变血红色证明含有,反应的离子方程式为:Fe3++3SCN-?Fe(SCN)3,故答案为:Fe3++3SCN-?Fe(SCN)3;
(3)沉淀A判断为SiO2;与萤石(CaF2)在硫酸酸化下可以制备石膏硫酸钙,可以理解为浓硫酸和氟化钙反应生成氢氟酸和硫酸钙,氢氟酸和二氧化硅反应生成四氟化硅和水,反应的化学方程式为:2CaF2+2H2SO4+SiO2═2CaSO4+SiF4↑+2H2O,故答案为:2CaF2+2H2SO4+SiO2═2CaSO4+SiF4↑+2H2O;
(4)从沉淀混合物B中制取D,实验流程为了制备碳酸镁,所以操作2氢氧化钙需要适量,控制溶液pH小于9.4,不能沉淀镁离子,且使铝离子和铁离子全部生成沉淀,判断沉淀B为氢氧化铝、氢氧化铁,加热得到红色氧化物,判断氢氧化铁得到红色物质推断为氧化铁,所以需要加入过量氢氧化钠溶液溶解氢氧化铝为偏铝酸钠溶液,过滤得到氢氧化铁沉淀,加热得到氧化铁实现,反应的离子方程式为:OH-+Al(OH)3═AlO2-+2H2O,故答案为:OH-+Al(OH)3═AlO2-+2H2O;
(5)依据转化关系分析实验目的,过程为了制备碳酸镁,所以操作2氢氧化钙需要适量,控制溶液pH小于9.4,不能沉淀镁离子,且使铝离子和铁离子全部生成沉淀,氢氧化铝是两性氢氧化物,所以碱不能过量,所以pH应控制在7-8最合适,故答案为:C;
(6)利用水合碱式碳酸镁[xMgCO3?yMg(OH)2?zH2O]的组成,分析判断实验装置的应用,测定分解产物中的水,二氧化碳,固体质量分别计算得到,加热分解得到固体为氧化镁;要求加热分解环境不含水、二氧化碳;测定装置不能和空气相连;所以装置连接顺序应为:空气通入氢氧化钠溶液除去二氧化碳→通过浓硫酸干燥除去水蒸气→通入加热分解的玻璃管→通过浓硫酸吸收生成水蒸气→通过碱石灰干燥管吸收生成的二氧化碳→通过浓硫酸或碱石灰防止空气中的水蒸气和二氧化碳进入测定装置,影响实验测定;实验连接顺序为:C-→B-→A-→B-→D-→B(或D);装置C应盛的试剂是氢氧化钠溶液;加热分解得到固体为MgO,二氧化碳是碳酸镁受热分解生成的,实验测得硬质玻璃管中剩余固体8.0g,所以氧化镁的物质的量=
| 8.0g |
| 40g/L |
| 6.6g |
| 44g/mol |
| 2.7g |
| 18g/mol |
故答案为:C-→B-→A-→B-→D-→B(或D);氢氧化钠溶液;3:1:3.

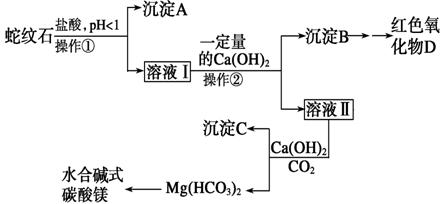
(17分)蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
实验步骤如下:
请回答下列问题:
(1)实验室完成操作①所用到的玻璃仪器有________________ 。
(2)检验溶液Ⅱ中是否含有Fe3+的操作与结论是___________________________
_____________________________________________________________________。
(3)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________________________________________________________________________,
再进行__________、 、 (依次填写实验操作名称)。
(4)操作②中应控制溶液pH的合理范围是____(填序号)。
A.小于1.5 B.1.5~3.3
C.7~8 D.大于9.4
(5)为探究所得的水合碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的组成,取样7.28 g于装置A的玻璃管中,请按由左―→右顺序将下列装置连接好(填序号,装置可重复使用):________________________________________________________________________,
装置C应盛的试剂是______________________。
(17分)蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
实验步骤如下:
请回答下列问题:
(1)实验室完成操作①所用到的玻璃仪器有________________ 。
(2)检验溶液Ⅱ中是否含有Fe3+的操作与结论是___________________________
_____________________________________________________________________。
(3)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________________________________________________________________________,
再进行__________、 、 (依次填写实验操作名称)。
(4)操作②中应控制溶液pH的合理范围是____(填序号)。
A.小于1.5 B.1.5~3.3
C.7~8 D.大于9.4
(5)为探究所得的水合碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的组成,取样7.28 g于装置A的玻璃管中,请按由左―→右顺序将下列装置连接好(填序号,装置可重复使用):________________________________________________________________________,
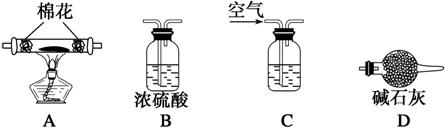
装置C应盛的试剂是______________________。