题目内容
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用_____________________________。
该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取2 mL上述FeSO4溶液于试管中,逐滴加入少量0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1 KSCN溶液无现象,通入一段时间O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入5% H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是FeS。Na2S 溶液呈碱性,FeSO4溶液与其反应不生成Fe(OH) 2而生成FeS的可能原因是_____________________。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:___________、_____________。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. Fe3+ 被H2O2还原 b. SCN- 被O2氧化 c. SCN- 被H2O2氧化
乙同学根据上述实验现象认为假设b不成立,他依据的现象是________________。
甲同学利用上述部分试剂,通过以下实验验证了假设c成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加FeCl3溶液 | ①_________ |
ii | ② _________________ | ③_________ |
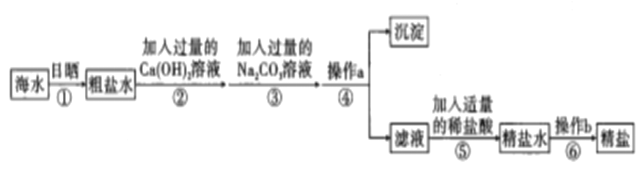
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

① C、D中的溶液依次是__________、________(填字母标号)。
a.品红溶液 b.NaOH溶液 c.BaCl2 溶液
d.Ba(NO3)2 溶液 e.浓H2SO4
② C、D中有气泡冒出,并可观察到的现象分别是____________ 、______________。
③ 写出硫酸亚铁高温分解反应的化学方程式______________________________。
【答案】Fe2++ 2H2O ![]() Fe(OH)2+2H+ 加入稀硫酸,增大H+,浓度,平衡左移,抑制Fe2+水解 FeS溶解度更小 4Fe2++ O2 +4H+ = 4Fe3++ 2H2O Fe3++3SCN-
Fe(OH)2+2H+ 加入稀硫酸,增大H+,浓度,平衡左移,抑制Fe2+水解 FeS溶解度更小 4Fe2++ O2 +4H+ = 4Fe3++ 2H2O Fe3++3SCN-![]() Fe(SCN)3 实验ⅱ中加入少量KSCN溶液无现象,通入一段时间O2,溶液变为浅红色。 无明显现象 取褪色后的溶液滴加KSCN溶液 溶液变为红色 c、a 产生白色沉淀 品红溶液褪色 2FeSO4
Fe(SCN)3 实验ⅱ中加入少量KSCN溶液无现象,通入一段时间O2,溶液变为浅红色。 无明显现象 取褪色后的溶液滴加KSCN溶液 溶液变为红色 c、a 产生白色沉淀 品红溶液褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
(1)亚铁离子在溶液中会发生水解;
(2)结合溶解度大小分析;
(3)KSCN溶液遇Fe3+会变红;考虑氧气氧化Fe2+转化为Fe3+导致溶液变红;
(4)结合实验ⅱ种现象可排除假设b;结合假设c的结论,通过对照实验验证KSCN可与过氧化氢反应;
(5)硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,D为品红,可用于检验SO2。
(1)硫酸亚铁溶液中存在水解平衡,其方程式为:Fe2++ 2H2O ![]() Fe(OH)2+2H+,当加入稀硫酸后,增大H+浓度,平衡左移,抑制Fe2+水解,
Fe(OH)2+2H+,当加入稀硫酸后,增大H+浓度,平衡左移,抑制Fe2+水解,
故答案为:Fe2++ 2H2O ![]() Fe(OH)2+2H+,加入稀硫酸,增大H+浓度,平衡左移,抑制Fe2+水解;
Fe(OH)2+2H+,加入稀硫酸,增大H+浓度,平衡左移,抑制Fe2+水解;
(2)FeSO4溶液与Na2S反应不生成Fe(OH) 2而生成FeS的可能原因是FeS更难溶,反应更容易进行,所以得到FeS沉淀,
故答案为:FeS溶解度更小;
(3)取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1 KSCN溶液无现象,通入一段时间O2,溶液变为浅红色,说明氧气将Fe2+氧化为Fe3+,反应的离子方程式为:4Fe2++ O2 +4H+ = 4Fe3++ 2H2O,Fe3++3SCN-![]() Fe(SCN)3,
Fe(SCN)3,
故答案为: 4Fe2++ O2 +4H+ = 4Fe3++ 2H2O 、Fe3++3SCN-![]() Fe(SCN)3;
Fe(SCN)3;
(4)乙同学根据上述实验现象认为假设b不成立,主要依据实验实验ⅱ中加入少量KSCN溶液无现象,通入一段时间O2,溶液变为浅红色;甲同学可先取褪色后溶液一份滴加FeCl3溶液,观察若无现象,再取褪色后的溶液滴加KSCN溶液,溶液变为红色,则可得出结论,SCN- 被H2O2氧化,假设c成立,
故答案为:实验ⅱ中加入少量KSCN溶液无现象,通入一段时间O2,溶液变为浅红色;无明显现象;取褪色后的溶液滴加KSCN溶液;溶液变为红色;
(5)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色,
故答案为:c、a;
②依据①中分析C、D中的溶液分别是氯化钡溶液与品红溶液,所以现象分别为:产生白色沉淀、品红褪色,
故答案为:产生白色沉淀、品红溶液褪色;
③硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑,
Fe2O3+SO2↑+SO3↑,
故答案为:2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下列“实验结论”与“实验操作及现象”相符合的一组是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+ 的氧化性强于Cu2+ 的氧化性 |
D | ①某溶液中加入Ba(NO3)2溶液,产生白色沉淀 ②再加足量盐酸仍有白色沉淀 | 原溶液中有SO42- |
A. AB. BC. CD. D
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
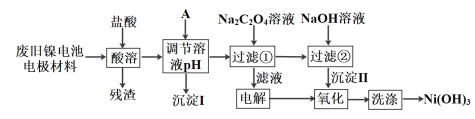
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③已知生成氢氧化物沉淀的pH如下表所示。
开始沉淀时 | 完全沉淀时 | |
Al(OH)3 | 3.43 | 4.19 |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
回答下列问题:
(1)加入试剂A来调节溶液的pH至5左右,试剂A最好选用________。
a.NaOH b.Na2CO3 c.NiO
该过程析出沉淀的成分是____________________(填化学式)。
(2)加入Na2C2O4溶液发生反应的化学方程式是_____________________。
(3)电解时的阴极电极反应式是____________________________。检验阳极产生的气体的试剂是_____________________________ 。
(4)沉淀Ⅱ可被电解所得阳极产物氧化,该反应的离子方程式是____________。
(5)检验Ni(OH)3已洗涤干净的方法是________________________________。