题目内容
9.下列单质或化合物性质的描述正确的是( )| A. | 加入铝粉能产生H2的溶液中,一定存在大量的Na+,Ba 2+,AlO2-,NO3- | |
| B. | SiO2与酸,碱均不反应 | |
| C. | NO2溶于水时发生氧化还原反应 | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
分析 A.加入铝粉能产生H2的溶液中存在大量氢离子或氢氧根离子,偏铝酸根离子与氢离子反应,硝酸根离子在酸性条件下具有强氧化性,与铝反应不会生成氢气;
B.二氧化硅能够与氢氧化钠、氢氟酸发生反应;
C.二氧化氮与水反应生成硝酸和NO气体,发生了氧化还原反应;
D.铁与氯气点燃生成氯化铁,与反应物的量无关.
解答 解:A.加入铝粉能产生H2的溶液为酸性或强碱性溶液,AlO2-与酸性溶液中的氢离子反应,NO3-在酸性条件下与铝反应不会生成氢气,在酸性溶液中不能大量共存,故A错误;
B.二氧化硅为酸性氧化物,能够与氢氧化钠溶液反应生成硅酸钠和水,还能够与氢氟酸反应生成四氟化硅,故B错误;
C.NO2溶于水生成硝酸和NO,存在化合价的变化,属于氧化还原反应,故C正确;
D.Fe在足量Cl2中燃烧,无论反应物是否过量,反应都生成生成FeCl3,故D错误;
故选C.
点评 本题考查了离子共存的判断、氮的氧化物的性质、铁的化学性质等知识,题目难度中等,明确离子共存的条件、氮的氧化物的性质为解答关键,注意铁与氯气燃烧中,无论反应物是否过量,反应都生成氯化铁.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.同温同压下同体积的A、B两种气体,经测定A的质量是2.0g,B的质量是0.50g,A的相对分子质量是64,则B是( )
| A. | NH3 | B. | O2 | C. | SO2 | D. | CH4 |
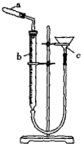
4.用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)( )


| A. | ②中试剂为饱和NaHCO3溶液 | |
| B. | 打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊 | |
| C. | 苯酚的酸性弱于碳酸 | |
| D. | ③中发生反应的化学方程式是 |
14.根据下列物质的化学性质,判断其应用错误的是( )
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 明矾溶于水产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 合金的性质与其组成金属的性质不完全相同,合金用途更广泛 |
1.工业制硫酸的一步重要反应是:2SO2+O2$?_{催化剂}^{400-500℃}$2SO3,下列说法错误的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度相等 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 在上述条件下,SO2不可能100%地转化为SO3 |
19.下列关于洗涤剂的说法中,正确的是( )
| A. | 肥皂不适宜在硬水、海水、酸性水中使用 | |
| B. | 纯棉织品、丝绸织品都不适宜用加酶洗衣粉洗涤 | |
| C. | 洗衣粉产生的泡沫越多,去污的效果越好 | |
| D. | 为了提高去污能力,各种类型的洗涤剂均可混合使用 |
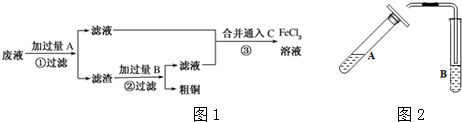
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.