题目内容
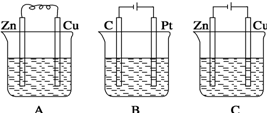
(10分)如图所示,常温,U形管内盛有100mL的溶液,请按要求回答下列问题。
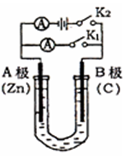
(1)若所盛溶液为CuSO4溶液,打开K2,闭合K1,则:
A为 极(填“正、负”),B极的电极反应式为 。
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,闭合K2,则:
①A电极可观察到的现象是
②总反应的化学方程式是
③反应一段时间后打开K2 ,若忽略溶液的体积变化和气体
的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,
将溶液充分混合,溶液的C(OH-)为

(1)若所盛溶液为CuSO4溶液,打开K2,闭合K1,则:
A为 极(填“正、负”),B极的电极反应式为 。
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,闭合K2,则:
①A电极可观察到的现象是
②总反应的化学方程式是
③反应一段时间后打开K2 ,若忽略溶液的体积变化和气体
的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,
将溶液充分混合,溶液的C(OH-)为
((10分)(1) 负 、 Cu2++2e- = Cu (2)① 产生气泡,溶液变红
② 2NaCl+2H2O通电 2NaOH+ H2↑+Cl2↑ ③ 0.01 mol/L (各2分)
② 2NaCl+2H2O通电 2NaOH+ H2↑+Cl2↑ ③ 0.01 mol/L (各2分)
(1)若所盛溶液为CuSO4溶液,打开K2,闭合K1,即为原电池,由于锌更活泼,为原电池的负极,B极则为正极,其电极反应式为:Cu2++2e- = Cu;
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,闭合K2,即为电解池,B极为阳极,A极为阴极,A极现象为:产生气泡,溶液变红;总反应方程式为:2NaCl+2H2O通电 2NaOH+ H2↑+Cl2↑;反应一段时间后打开K2 ,若忽略溶液的体积变化和气体
的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,
将溶液充分混合,溶液的C(OH-)为0.01 mol/L;
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,闭合K2,即为电解池,B极为阳极,A极为阴极,A极现象为:产生气泡,溶液变红;总反应方程式为:2NaCl+2H2O通电 2NaOH+ H2↑+Cl2↑;反应一段时间后打开K2 ,若忽略溶液的体积变化和气体
的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,
将溶液充分混合,溶液的C(OH-)为0.01 mol/L;

练习册系列答案
相关题目
 Cd(OH)2(s) + 2 Ni(OH)2(s)
Cd(OH)2(s) + 2 Ni(OH)2(s) 2PbSO4+2H2O
2PbSO4+2H2O 
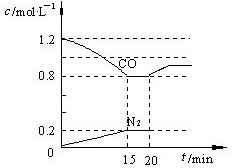
 N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。