题目内容
(14分)已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去):
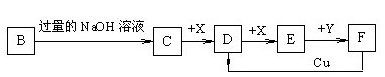
请回答下列问题:
(1)B的化学式为 ;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为 ,反应中的还原剂为 ;
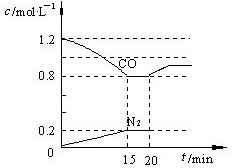
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g) N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为 K = ;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将 移动(填“向左”、“向右”或“不”)
③20 min时,若改变反应条件,导致CO浓度发生如图
所示的变化,则改变的条件可能是 (填序号);
a.缩小容器体积 b.增加CO2的量
c.升高温度 d.加入催化剂

请回答下列问题:
(1)B的化学式为 ;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为 ,反应中的还原剂为 ;
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g)
 N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。①该反应的化学平衡常数为 K = ;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将 移动(填“向左”、“向右”或“不”)
③20 min时,若改变反应条件,导致CO浓度发生如图
所示的变化,则改变的条件可能是 (填序号);

a.缩小容器体积 b.增加CO2的量
c.升高温度 d.加入催化剂
(1)NH4Cl(2分);3Cu+2NO3-+8H+= 3Cu2++2NO↑+4H2O(2分)
(2) NH3 + 3Cl2 = NCl3 +3HCl(2分),Cl2(2分)
(3)①0.05 L·mol-1 ②向左 ③ b c (每空2分)
(2) NH3 + 3Cl2 = NCl3 +3HCl(2分),Cl2(2分)
(3)①0.05 L·mol-1 ②向左 ③ b c (每空2分)
本题是一道综合性比较强的题目,对物质的推断是解题的关键。B为正盐,能与NaOH反应,故为铵盐,C为氨气,CDEF,为连续氧化,溶于水形成酸的过程,又因能与铜反应,也可以推测为HNO3,平衡分析中他,通入0.8molNO和N2平衡移动方向问题可有平衡常数进行解决。
K===0.05,Q===0.0625,Q>K,平衡逆向移动。
| | 2NO(g) + 2CO(g)  N2(g) + 2CO2(g);△H<0 N2(g) + 2CO2(g);△H<0 | |||
| 始态mol | 1.4 | 1.2 | 0 | 0 |
| 反应mol | 0.4 | 0.4 | 0.2 | 0.4 |
| 终态mol | 1.0 | 0.8 | 0.2 | 0.4 |
| 再次通入 | 0 | 0.8 | 0.8 | 0 |
| 通入后 | 1.0 | 1.6 | 1.0 | 0.4 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目