题目内容
【题目】常温下,已知H2A的电离平衡常数为: K1=1.3×10-7 K2=7.1×10-15现有常温下的0.1mol/L NaHA溶液。
(1)请写出H2A的电离方程式______
(2)已知NaHA溶液pH>7,请解释原因_________
(3)请写出NaHA溶液中的电荷守恒式__________
(4)NaHA溶液中粒子之间的关系式中正确的是________
A.c(A2-)+c(HA-)=0.1mol/L B.c(H+)=c(OH-)+c(A2-)
C.c(HA-)>c(OH-)>c(A2-) D.c(A2-)>c(H2A)
(5)如果H2A为H2S,则向NaHS溶液中滴加硫酸铝溶液,发生反应的离子方程式________
【答案】 )H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2- HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性 [Na+]+[H-]=[OH-]+[HA-]+2[A2-] C Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑
H++A2- HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性 [Na+]+[H-]=[OH-]+[HA-]+2[A2-] C Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑
【解析】(1)H2A是二元弱酸,则H2A的电离方程式为H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-;(2)HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性;(3)NaHA溶液中的电荷守恒式为[Na+]+[H-]=[OH-]+[HA-]+2[A2-];(4)A.根据物料守恒可知c(A2-)+c(HA-)+c(H2A)=0.1mol/L,A错误;B.根据质子守恒可知c(H+)=c(OH-)+c(A2-)-c(H2A),B错误;C.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(HA-)>c(OH-)>c(A2-),C正确;D.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(A2-)<c(H2A),D错误,答案选C;(5)铝离子和HS-水解相互促进,则方程式为Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑。
H++A2-;(2)HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性;(3)NaHA溶液中的电荷守恒式为[Na+]+[H-]=[OH-]+[HA-]+2[A2-];(4)A.根据物料守恒可知c(A2-)+c(HA-)+c(H2A)=0.1mol/L,A错误;B.根据质子守恒可知c(H+)=c(OH-)+c(A2-)-c(H2A),B错误;C.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(HA-)>c(OH-)>c(A2-),C正确;D.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(A2-)<c(H2A),D错误,答案选C;(5)铝离子和HS-水解相互促进,则方程式为Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑。

 名校课堂系列答案
名校课堂系列答案【题目】化学是一门实验科学,化学反应过程中的能量变化和速率变化是中学化学研究的重要内容
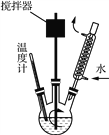
Ⅰ.利用如图所示装置测定中和热
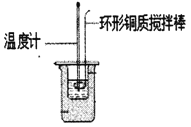
(1)图中明显有一处错误,请指出___________
(2)________(填“能”或“不能”)用Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸进行中和热测定
Ⅱ.探究硫酸铜的量对氢气生成速率的影响。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(1) 请完成此实验设计,其中: V8=_________
(2) 当CuSO4溶液少量时,反应速率明显加快,原因_______
(3) 当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:______________