题目内容
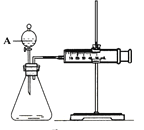
【题目】用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0mL 0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下:
时间/s | 0 | t | 2t | ...... |
活塞的位置/mL | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是 ___________________。
(2)仪器A的名称是__________________________。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是_______,原因是______________。
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
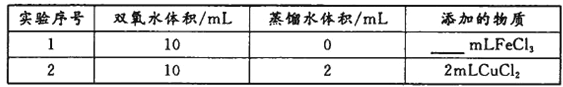
①上表中需要添加的物质是_________mL FeCl3溶液。
②本实验需要测定的数据是____________________________。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
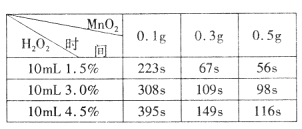
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________ g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_____________。(提示:H2O2溶液的密度可认为近似相等。)
(6)50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。
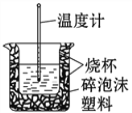
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是____________________,烧杯间填满碎泡沫塑料的作用是____________________________________。大烧杯上如不盖硬纸板,则求得的中和热数值____________(填“偏大” “偏小”或“无影响”)。
(7)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
【答案】将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好(其他合理方案也可)分液漏斗t-2t镁与硫酸反应放热,温度升高,反应速率加快4收集相同体积的氧气所需时间(或相同时间产生氧气的体积)加快0.3不正确H2O2的浓度扩大2倍(从1.5%-3.0%),但反应所需时间比其2倍小得多环形玻璃搅拌减少热量损失偏小-53.8kJ/ mol
【解析】
(1)通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象判断装置气密性,所以检验该套装置的气密性的方法为:将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好,故答案为:将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好;
(2)根据实验室常见仪器名称判断,盛装双氧水的化学仪器A具有活塞装置的漏斗,名称是分液漏斗,故答案为:分液漏斗;
(3)0-ts,生成气体25.6-17.3=8.3mL,t-2t,生成气体36.6-25.6=11mL,相同时间生成气体的体积t-2t 多,所以t-2t 快,是因为镁与硫酸反应放热,温度升高,反应速率加快,故答案为:t-2t;镁与硫酸反应放热,温度升高,反应速率加快;
(4)①该实验的目的为探究催化剂对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,实验1和2需体积相同,所以需4mLFeCl3,故答案为:4;
②探究Fe3+、Cu2+对双氧水分解速率的影响,可以通过过氧化氢分解生成的氧气的量判断,可收集相同体积的氧气所需时间(或相同时间产生氧气的体积)测定,故答案为:收集相同体积的氧气所需时间(或相同时间产生氧气的体积);
(5)①由表中数据可知,双氧水的量相同,加入的二氧化锰质量越多,反应所需的时间越短,说明反应速率越快,故答案为:加快;
②根据表中数据,在双氧水的浓度相同时,加入0.3g二氧化锰与加入0.1g二氧化锰对化学反应速率影响相差较大,加入0.3g二氧化锰与加入0.5g二氧化锰对反应速率的影响相差不是很大,所以加入二氧化锰的最佳量为0.3g,故答案为:0.3;
③从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的双氧水中溶质含量的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式(v=![]() )可得出,此实验条件下双氧水的浓度越大分解速率越快,故答案为:不正确;H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多;
)可得出,此实验条件下双氧水的浓度越大分解速率越快,故答案为:不正确;H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多;
(6)该实验中还缺少环形玻璃搅拌棒,搅拌混合溶液使溶液混合均匀;泡沫有保温性能,所以其作用是保温隔热,防止热量散失;大烧杯上如不盖硬纸板,会导致部分热量散失,导致测定结果偏小,故答案为:环形玻璃搅拌棒;保温隔热,减少热量散失;偏小;
(7)第1次实验盐酸和NaOH溶液起始平均温度为20.1℃,反应后温度为:23.2℃,反应前后温度差为:3.1℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.4℃,反应后温度为:25.6℃,反应前后温度差为:5.2℃,与前2次相差较大,不符合要求,删除;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×![]() =1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×
=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×![]() =51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJmol-1。
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJmol-1。

 名校课堂系列答案
名校课堂系列答案