题目内容
【题目】某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化(结果如图2).下列叙述错误的是( )
A.图2中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀
B.碳粉表面的电极反应式只有:2H2O+O2+4e﹣═4OH﹣
C.碳粉表面一定发生了还原反应
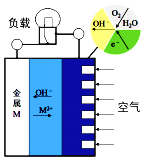
D.图3中,发生腐蚀时电子转移方向如箭头所示
【答案】B
【解析】A、从胶头滴管中滴入几滴醋酸溶液,开始时锥形瓶中压强增大,说明铁粉发生了析氢腐蚀,后随着醋酸的消耗,溶液酸性减弱,故发生了吸氧腐蚀,则锥形瓶中压强减小,故A不符合题意;
B、铁粉和碳粉形成原电池,碳粉做正极,开始时发生析氢腐蚀,正极反应为2H++2e﹣=H2↑,后发生吸氧腐蚀,正极反应为:2H2O+O2+4e﹣═4OH﹣,故B符合题意;
C、在形成的原电池中,碳粉做正极,故碳粉表面一定发生还原反应,故C不符合题意;
D、在形成的原电池中,铁粉做负极失去电子,碳粉做正极,氢离子或氧气在正极得电子,故电子的转移方向是由负极移向正极,故D不符合题意.
所以答案是:B.
【考点精析】本题主要考查了金属的电化学腐蚀与防护的相关知识点,需要掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法才能正确解答此题.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目