题目内容
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
| A.800℃下,该反应的化学平衡常数为0.25 |
| B.427℃时该反应的平衡常数为9.4,则该反应的△H>0 |
| C.800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D.800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
D
解析试题分析: CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 1 1 0 0
转化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 0.5 0.5 0.5 0.5
由于反应前后体积不变,则可以用物质的量来计算平衡常数,即A、该温度下反应的平衡常数K= =1,A不正确;B、427℃时该反应的平衡常数为9.4,这说明降低温度平衡向正反应方向移动,因此正方应是放热反应,即该反应的△H<0,B不正确;C、此时CO的转化率是
=1,A不正确;B、427℃时该反应的平衡常数为9.4,这说明降低温度平衡向正反应方向移动,因此正方应是放热反应,即该反应的△H<0,B不正确;C、此时CO的转化率是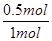 ×100%=50%,800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡向正反应方向移动,但CO的转化率降低,因此剩余CO的物质的量大于2mol-2mol×50%=1mol,则平衡时CO物质的量分数小于
×100%=50%,800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡向正反应方向移动,但CO的转化率降低,因此剩余CO的物质的量大于2mol-2mol×50%=1mol,则平衡时CO物质的量分数小于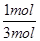 ×100%=33.3%,C不正确;D、800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则
×100%=33.3%,C不正确;D、800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 1 2 0 0
转化量(mol) x x x x
平衡量(mol)1-x 2-x x x
因此有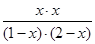 =1
=1
解得x=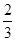
所以平衡时CO转化率为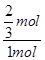 ×100%=66.7%,D正确,答案选D。
×100%=66.7%,D正确,答案选D。
考点:考查可逆反应的有关计算

已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)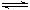 N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是
N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是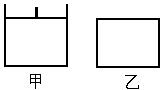
| A.平衡时NO2体积分数:甲<乙 |
| B.达到平衡所需时间,甲与乙相等 |
| C.该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |
已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是 ( )
2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是 ( )
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( ) 
| 选项 | x | y |
| A | 降温 | A的体积分数 |
| B | 升高温度 | 混合气体的密度 |
| C | 再加入A | B的转化率 |
| D | 再加入C | A的体积分数 |
在密闭容器中进行下列反应M(g)+N(g)  R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )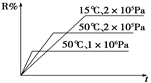
| A.正反应放热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应吸热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
 2C(g) ΔH<0这个可逆反应的正确图像为( )
2C(g) ΔH<0这个可逆反应的正确图像为( )