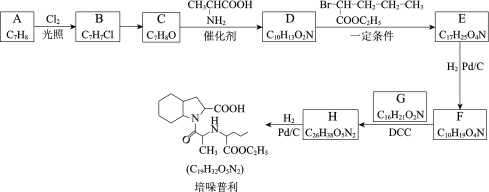
题目内容
【题目】已知煤炭的燃烧热为393.15kJ·mol-1,氢气的燃烧热为242kJ·mol-1,一氧化碳的燃烧热为283 kJ·mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧得更旺,因此该同学得出结论:煤炭燃烧时加少量水,可使煤炭在燃烧时放出更多的热量。下列有关说法正确的是( )
A.表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
B.表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-283 kJ·mol-1
C.“煤炭燃烧得更旺”是因为少量固体碳转化成了可燃性气体
D.因242kJ·mol-1+283kJ·mol-1>393.15kJ·mol-1,故该同学的结论是对的
【答案】C
【解析】
A选项,氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)= H2O(l) ΔH=-242kJ·mol-1,应该是生成H2O(l),故A错误;
O2(g)= H2O(l) ΔH=-242kJ·mol-1,应该是生成H2O(l),故A错误;
B选项,CO燃烧热的热化学方程式为CO(g)+![]() O2(g)= CO2(g) ΔH=-283 kJ·mol-1,故B错误;
O2(g)= CO2(g) ΔH=-283 kJ·mol-1,故B错误;
C选项,“煤炭燃烧得更旺”是因为少量固体碳转化成了可燃性气体,燃烧会更旺,故C正确;
D选项,在煤炭和水反应时是一个吸热反应,先吸收了一定的热量,再是氢气和一氧化碳燃烧反应放出的热量242kJ·mol-1+283kJ·mol-1,实际上把吸收的热量减去,总共放出的热量依然是393.15kJ·mol-1,故D错误;
综上所述,答案为C。

 名校课堂系列答案
名校课堂系列答案【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。
(1)不同温度下工业合成氨N2(g)+3H2(g)![]() 2NH3(g)反应的部分K值如下表。
2NH3(g)反应的部分K值如下表。
温度/℃ | 25 | 400 | 450 |
K | 5×108 | 0.507 | 0.152 |
①工业合成氨反应平衡常数表达式为K=___。
②请结合平衡常数解释,该反应为放热反应的理由___。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因___。
(2)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
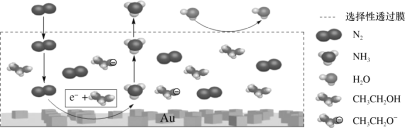
①阴极区生成NH3的电极方程式为___。
②下列说法不正确的是___(填字母序号)。
a.三氟甲磺酸锂的作用是增强导电性
b.该装置用金(Au)作催化剂目的是降低N2的键能
c.选择性透过膜可允许N2和NH3通过,防止H2O进入装置