题目内容
【题目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况),假设电解后溶液的体积仍为500mL.下列说法正确的是( )
A.原混合溶液中K+的物质的量浓度为1 mol/L
B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中H+的物质的量浓度为2mol/L
【答案】B
【解析】解:两极都收集到22.4L气体(标准状况),气体物质的量为1mol,
阳极反应为:
4OH﹣﹣ | 4e﹣=2H2O+ | O2↑ |
4mol | 4mol | 1mol |
电解过程中电子转移总数为4mol,两电极电子转移相同;
阴极反应为:
Cu2++ | 2e﹣= | Cu; | 2H++ | 2e﹣= | H2↑ |
1mo | 2mol | 1mo | 2mol | 2mol | 1mo |
根据500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L,C(Cu2+)= ![]() =2mol/L,溶液中存在电荷守恒为:[K+]+2[Cu2+]=[NO3﹣],计算[K+]=2mol/L;
=2mol/L,溶液中存在电荷守恒为:[K+]+2[Cu2+]=[NO3﹣],计算[K+]=2mol/L;
A、计算可知原混合溶液中K+的物质的量浓度为2 mol/L,故A错误;
B、上述电解过程中共转移4mol电子,故B正确;
C、电解得到的Cu的物质的量为1mol,故C错误;
D、电解后溶液中H+的物质的量浓度是氢氧根离子减少的量减去氢离子减少量,浓度= ![]() =4mol/L,故D错误;
=4mol/L,故D错误;
故选B.

【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.
(1)4CO(g)+2NO2(g)═4CO2(g)+N2(g)△H=﹣1 200kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号).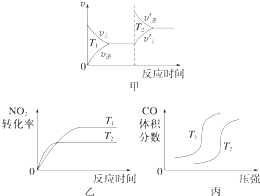
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.
820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0.
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为 .
②平衡时,甲容器中CO的转化率是 . 比较下列容器中CO的转化率:乙甲;丙甲(填“>”、“=”或“<”).
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度(填“升高”或“降低”),平衡常数K(填“增大”、“减小”或“不变”).