题目内容
【题目】(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g 硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42 物质的量浓度__________________。
【答案】 ![]() 16 18 18 0.5 6.02×1023或NA
16 18 18 0.5 6.02×1023或NA ![]() mol/L
mol/L ![]() mol/L
mol/L
【解析】(1)氯原子的原子序数是17,据此书写结构示意图;
(2)根据质子数+中子数=质量数以及质子数与核外电子数的关系解答;
(3)根据n=m/M以及硫酸是二元强酸计算;
(4)根据c=n/V计算。
(1)氯原子的原子序数是17,其结构示意图为![]() 。
。
(2)![]() 的质子数是16,中子数是34-16=18,核外电子数是16+2=18。
的质子数是16,中子数是34-16=18,核外电子数是16+2=18。
(3)49g 硫酸的物质的量为49g÷98g/mol=0.5mol,硫酸是二元强酸,其完全电离产生H+的物质的量是0.5mol×2=1mol,个数为6.02×1023或NA。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,铝离子的物质的量是![]() ,则溶液中Al3+的物质的量浓度为
,则溶液中Al3+的物质的量浓度为![]() ;根据化学式可知SO42物质的量浓度为
;根据化学式可知SO42物质的量浓度为![]() 。
。

【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
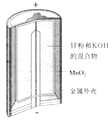
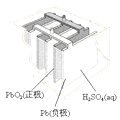
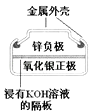
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag