题目内容
常温下,0.1mol的金属Na、Mg、Al分别投入到足量的稀盐酸中,完全反应后产生的氢气( )
| A、镁、铝一样多 |
| B、钠放出的多 |
| C、镁放出的多 |
| D、铝放出的多 |
考点:化学方程式的有关计算
专题:计算题
分析:常温下,金属Na、Mg、Al和盐酸反应都生成氯化物和氢气,反应过程中转移电子相等,根据转移电子相等进行计算.
解答:
解:常温下,金属Na、Mg、Al和盐酸反应都生成氯化物和氢气,0.1mol的金属Na、Mg、Al完全反应失去电子的物质的量分别是0.1mol、0.2mol、0.3mol,反应过程中转移电子相等,所以金属失去电子数越多,得到的氢气越多,所以铝生成的氢气最多,
故选D.
故选D.
点评:本题考查了根据方程式的计算,明确氧化还原反应中转移电子相等是解本题关键,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
下列物质一定属于同系物的是( )


| A、⑤⑦ | B、④⑥ | C、⑥⑧ | D、①③ |
从化学角度分析,下列叙述不正确的是( )
| A、SO2,NOx的排放均可导致酸雨的形成 |
| B、辽宁舰简体喷高分子膜,舰底镶嵌锌片均可用于防腐 |
| C、美国催促日本归还放射物质钚(Pu),238Pu和239Pu互为同位素 |
| D、石油的裂解和煤的干馏都是化学变化,二油脂的皂化是物理变化 |
一定量的镁铝合金与500mL 1mol?L-1 HNO3完全反应生成2.24LNO(标况),再向反应后的溶液中加入2mol?L-1 NaOH溶液,使镁、铝元素完全沉淀,则所加NaOH溶液体积是( )
| A、50mL | B、100mL |
| C、150mL | D、200mL |
在氧气中灼烧有硫元素和铁元素组成的化合物0.44g,使其中的硫全部转化为二氧化硫,并将二氧化硫,全部氧化成硫酸,这些硫酸与20mL 0.5mol?L-1氢氧化钠溶液恰好完全中和,则原化合物中硫的质量分别约为( )
| A、18% | B、46% |
| C、53% | D、36% |
下列有关化学用语表示正确的是( )
A、Be原子的结构示意图: | ||
B、乙酸的结构简式: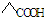 | ||
C、中子数为16的硫原子:
| ||
D、NH4Cl的电子式: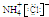 |
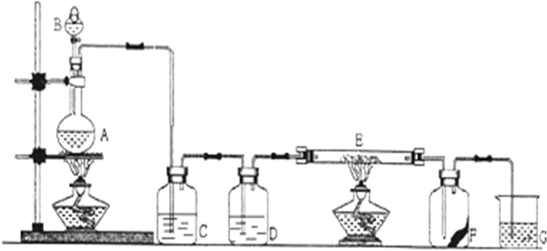
利用如图装置可实现在铜片上镀镍,下列有关说法不正确的是( )


| A、a为正极,d极为铜片 |
| B、甲池是燃料电池、乙池是电镀池 |
| C、b极上发生的电极反应为:CH4+10OH--8e-═CO32-+7H2O |
| D、c极上发生的电极反应为:Ni2++2e-═Ni |