��Ŀ����
����Ŀ��ȡKClO3��MnO2�Ļ����16.60g���������أ�����Ӧ��Ĺ����15gˮ����ܽ⣬ʣ�����6.55g (25��)���ټ�5 gˮ����ܽ⣬��ʣ�����4.80g(25��)��
(1)��ʣ���4.80g����ȫ��MnO2����ԭ�������KClO3������Ϊ________________g(����2λС��)
(2)��ʣ���4.80g������MnO2��KCl�Ļ�����25��ʱKCl���ܽ��Ϊ_____��ԭ�������KClO3������Ϊ________________g(����2λС��)������KCl��Һ���ܶ�Ϊ1.72g/cm3������Һ�����ʵ���Ũ��Ϊ______mol/L(����2λС��)��
(3)�������·�Ӧ�Ʊ�KIO3��K2H3IO6(�ߵ��������)��I2+2KClO3=2KIO3+Cl2�� KIO3+Cl2+3KOH =K2H3IO6+2KCl �������Ƶõ�KIO3��K2H3IO6�����ʵ���֮��x�����Ƶ�100molK2H3IO6, ������ymolKClO3����ȷ��y��x�Ĺ�ϵʽ________________��
���𰸡�11.80 35g 12.25 5.99 y=100(1+x)
��������
(1)��ʣ���4.80g����ȫ��MnO2��m(KClO3)=������- m(MnO2)
(2)��ʣ���4.80g������MnO2��KCl�Ļ�����5gˮ�ܽ��Ȼ��صõ�����Һ�DZ�����Һ���ݴ˼������ܽ�ȣ���Ӧǰ���������ٵ�����Ϊ��������������������غ�����֮��Ĺ�ϵʽ��������ص�������������Һ�������ܶȼ�����Һ������ٽ��c=![]() ������Һ�����ʵ���Ũ�ȣ�
������Һ�����ʵ���Ũ�ȣ�
(3)�ɷ���ʽ��֪����������KClO3��Clԭ�ӵ����ʵ�������Iԭ�ӵ����ʵ�����
(1)��ʣ���4.80g����ȫ��MnO2��m(KClO3)=16.60g-4.80g=11.80g��
(2)��ʣ���4.80g������MnO2��KCl�Ļ�����5gˮ�ܽ��Ȼ��صõ�����Һ�DZ�����Һ��5gˮ�ܽ�KCl������=6.55g-4.80g=1.75g����100gˮ�ܽ�KCl������=![]() ��100g=35g����KCl���ܽ��Ϊ35g��20gˮ�ܽ��Ȼ��ص�����=1.75g��4=7g����Ӧǰ���������ٵ�����Ϊ����������������������=16.60g-7g-4.80g=4.8g��������ԭ���غ��ԭ�������KClO3������Ϊ
��100g=35g����KCl���ܽ��Ϊ35g��20gˮ�ܽ��Ȼ��ص�����=1.75g��4=7g����Ӧǰ���������ٵ�����Ϊ����������������������=16.60g-7g-4.80g=4.8g��������ԭ���غ��ԭ�������KClO3������Ϊ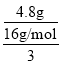 ��122.5g/mol=12.25g����Һ������=20g+7g=27g����Һ�����=
��122.5g/mol=12.25g����Һ������=20g+7g=27g����Һ�����=![]() ��n(KCl)=
��n(KCl)=![]() ������Һ�����ʵ���Ũ��=
������Һ�����ʵ���Ũ��=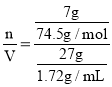 =5.99mol/L��
=5.99mol/L��
(3) �����Ƶõ�KIO3��K2H3IO6�����ʵ���֮��x�����Ƶ�100molK2H3IO6���������Ƶ�KIO3Ϊ100xmol����KIO3+Cl2+3KOH=K2H3IO6+2KCl��֪���Ƶ�100molK2H3IO6ʱ������KIO3100mol���������������ܹ��Ʊ�KIO3Ϊ100(1+x)mol�����I2+2KClO3=2KIO3+Cl2�ɵ����� KClO3�����ʵ���y=100(1+x)��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�����Ŀ�����������һ�ֵ��͵�ǿ���������ȷֽ��������ء��������̡����������������գ�
I. ��֪����MnO2(s)=Mn(s)+O2(g) ��H=+520kJ/mol
��S(s)+O2(g)=SO2(g) ��H=-297kJ/mol
��Mn(s)+2O2(g)+S(s)=MnSO4(s) ��H=-1065kJ/mol
��1������MnO2�Ͷ����������巴Ӧ����MnSO4������Ȼ�ѧ����ʽΪ________________��
II.�����Ƶζ����ⶨ������ص����������漰���ķ�Ӧ��
C2O42-+2H+��H2C2O4�����ᣩ
5H2C2O4+2MnO4-+6H+��2Mn2++10CO2��+8H2O
��2��������Ӧ��75��80����бȽϺ��ʣ��������¶ȴ���90��ʱ���ᵼ�²������������࣬��ԭ����______________________��
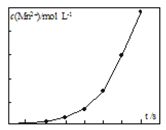
��3����һ�������������Һ���ữ�IJ�������Һ��ϣ���÷�Ӧ��Һ��Mn2+��Ũ���淴Ӧʱ��t�ı仯��ͼ��Mn2+Ũ�ȱ仯�ɻ��������Ѹ�������ԭ����____________________________��
III .KMnO4��һ�ֳ�����������
��4��KMnO4���������������������Ƶ���__________������ţ���
A. ˫��ˮ B.�����ƾ���75%�� C.����ˮ D. 84����Һ��NaClO��Һ��
��5��KMnO4����Ч�ʣ��õ�λ����ת�Ƶĵ�������ʾ����NaClO��______����������λС������
��6���ⶨKMnO4��Ʒ�Ĵ��ȿ��ñ�Na2SO3��Һ�ζ���
������250ml0.1000mol/L��Na2SO3��Һ����Ҫʹ�õIJ����������ձ�����ͷ�ιܡ���Ͳ����������____________��
��ȡijKMnO4��Ʒ0.7000g����ˮ��������____________�����ữ��
A. ϡ���� B.ϡ���� C.���� D. ������
�۽���������Һ��0.1000mol/L��Na2SO3��Һ���еζ����ζ����յ��¼ʵ������Na2SO3��Һ��������ظ�����ڡ��ۣ�����ƽ��ʵ�����������
ʵ����� | 1 | 2 | 3 |
����Na2SO3��Һ���/ml | 19.30 | 20.98 | 21.02 |
���й����ӷ���ʽΪ��2MnO4- + 5SO32- + 6H+ ��5SO42- + 2Mn2+ + 3H2O��
�����KMnO4��Ʒ�Ĵ���Ϊ__________����������λ��Ч���֣�