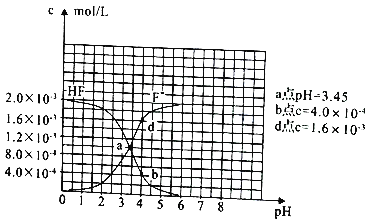
题目内容
【题目】(1)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)

(1)若A是一种黄色单质固体,则B→C的化学方程式为_______________。浓的D溶液使纸张变黑体现了它的___________性。
(2)若C是红棕色气体,则A化学式可能_________;写出稀的D溶液与铜反应的离于方程式___________________________________________。
(II)工业上治炼铝的原料是铝土(主要成分是A12O3,杂质为Fe2O3、FeO、SiO2等)。某研究小阻设计的提纯A12O3的方案如下

(3)滤液2中含有的溶质有NaOH、______和______(填化学式)。
(4)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2被空气氧化,写出其被氧化的化学方程式___________________________。
(5)写出通入过量CO2生成沉淀A时反应的离子方程式为__________________。
【答案】2SO2+O2![]() 2SO3 脱水 N2或NH3 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O NaAlO2 NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
2SO3 脱水 N2或NH3 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O NaAlO2 NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
(Ⅰ)A、B、C是中学化学常见的三种物质,A物质能连续氧化生成C,结合物质的性质分析判断;
(II)氧化铝、氧化铁以及氧化亚铁与盐酸反应,二氧化硅不反应,过滤得到的滤液1中含有氯化铁、氯化铝、氯化亚铁和盐酸,加入过量的氢氧化钠溶液,得到氢氧化亚铁、氢氧化铁、氯化钠和偏铝酸钠,氢氧化亚铁不稳定最终变为氢氧化铁,过滤得到偏铝酸钠和氢氧化钠以及氯化钠的混合溶液,通入过量二氧化碳生成氢氧化铝沉淀,氢氧化铝灼烧得到氧化铝,据此解答。
(Ⅰ)(1)若A是一种黄色单质固体,则A是单质硫,硫与氧气反应生成B是二氧化硫,二氧化硫氧化生成C为三氧化硫,三氧化硫溶于水生成D是硫酸。其中B→C的化学方程式为2SO2+O2![]() 2SO3。浓硫酸能使纸张变黑体现了它的脱水性。
2SO3。浓硫酸能使纸张变黑体现了它的脱水性。
(2)若C是红棕色气体,C是二氧化氮,则B是NO,因此A可能是氮气或氨气,其化学式分别是N2、NH3;稀硝酸具有强氧化性,与铜反应的离于方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(II)(3)反应中盐酸过量,因此滤液1中含有氯化铁、氯化铝、氯化亚铁和盐酸,加入过量的氢氧化钠溶液,得到氢氧化亚铁、氢氧化铁、氯化钠和偏铝酸钠,氢氧化亚铁不稳定最终变为氢氧化铁,过滤得到偏铝酸钠和氢氧化钠以及氯化钠的混合溶液,因此滤液2中含有的溶质有NaOH、NaAlO2、NaCl。
(4)Fe(OH)2易被空气氧化生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)偏铝酸钠溶液和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,则通入过量CO2生成沉淀A时反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。

 阅读快车系列答案
阅读快车系列答案【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
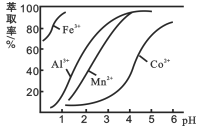
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________;丁装置中稀硫酸的作用是______________。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________管通入 __________气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水):
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________。
(6)根据侯氏制碱原理制备少量NaHCO

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是 ______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________。