题目内容
4. 已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中G溶液呈蓝色.回答以下问题:
已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中G溶液呈蓝色.回答以下问题:(1)E的化学式为Fe(NO3)3,B的化学式为Cu;
(2)E的饱和溶液加入到沸水中,溶液变为红褐色,其原因为(用离子方程式表示)Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
(3)反应①的离子方程式为Fe+4H++NO3-=Fe3++NO+2H2O;
(4)反应③的化学方程式为SO2+NO2+H2O=H2SO4+NO;
(5)写出用惰性电极电解G溶液的电解反应化学方程式2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
分析 两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,D为红棕色气体,则D为二氧化氮,由题中关系图可知,C为一氧化氮,E的饱和溶液加入到沸水中,溶液变为红褐色,则A为铁,所以X为稀硝酸,G溶液呈蓝色,则B为铜,Y为浓硫酸,G为硫酸铜,F为二氧化硫,据此答题.
解答 解:(1)根据上面的分析可知,E为Fe(NO3)3,B为Cu,故答案为:Fe(NO3)3;Cu;
(2)硝酸铁的饱和溶液加入到沸水中,铁离子水解生成氢氧化铁胶体,溶液变为红褐色,离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
(3)Fe和稀硝酸反应的离子方程式为Fe+4H++NO3-=Fe3++NO+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO+2H2O;
(4)二氧化硫和二氧化氮反应的化学方程式为SO2+NO2+H2O=H2SO4+NO,
故答案为:SO2+NO2+H2O=H2SO4+NO;
(5)用惰性电极电解硫酸铜溶液的电解反应化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
点评 本题主要考查了铁、铜及其化合物的常见性质,中等难度,解题的关键是物质的推断,答题时注意常见元素化合物知识的灵活运用及根据各物质之间的转化推断物质种类.

练习册系列答案
相关题目
14.下列叙述正确的是( )
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | CaCO3在水中的溶解度很小,故CaCO3为弱电解质 |
15.糖原[(C6H10O5)n]是一种相对分子质量比淀粉更大的多糖.主要存在于肝脏和肌肉中,常常称为动物淀粉或肝糖.下列有关糖原的叙述中正确的是( )
| A. | 糖原与纤维素互为同分异构体,与淀粉互为同系物 | |
| B. | 糖原能溶于水,有甜味 | |
| C. | 糖原水解的最终产物是葡萄糖 | |
| D. | 糖原具有还原性,是还原性糖 |
12.2010年上海世博会的主题是“城市,让生活更美好”.下列叙述中不正确的是( )
| A. | 世博会前期,净化自来水时加入ClO2作为消毒剂 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NO反应生成无毒气体 | |
| D. | 世博会中国馆一“东方之冠”使用的钢筋混凝土属于高分子化合物 |
19.下列叙述正确的是( )
| A. | 向某溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀产生,则溶液中一定含有SO42- | |
| B. | 氯气和二氧化硫湿润时均有漂白作用,若将二者等物质的量混合溶于水,漂白效果会增强 | |
| C. | 将稀硫酸滴到淀粉碘化钾试纸上,一段时间后变蓝,有反应4H++4I-+O2=2I2+2H2O发生 | |
| D. | 将足量的CO2逐渐通入含等物质的量的Ba(OH)2和KOH的混合溶液中,生成沉淀的物质的量与CO2的关系如图: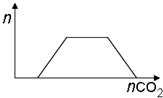 |
9.下列有关实验装置的说法中正确的是( )
| A. | 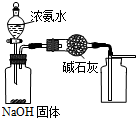 用图装置制取干燥纯净的NH3 | |
| B. | 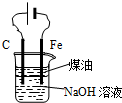 用图装置实验室制备Fe(OH)2 | |
| C. |  用图装置可以完成“喷泉”实验 | |
| D. |  用图装置测量Cu与浓硝酸反应产生气体的体积 |
16.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如下图所示.下列有关物质的推断正确的是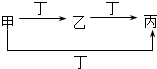 ( )
( )
 ( )
( )| 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关化学用语使用正确的是( )
| A. | CO2的电子式: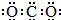 | |
| B. | 具有16个质子、16个中子和18个电子的微粒是${\;}_{16}^{32}$S | |
| C. | 甲酸钠的分子式:CHO2Na | |
| D. | 乙烯的比例模型: |
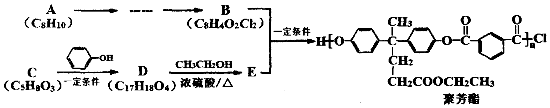
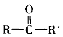 +2
+2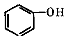 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$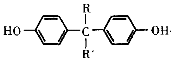 +H2O
+H2O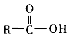 +SOCl2→
+SOCl2→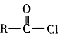 +SO2+HCl
+SO2+HCl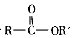 +HCl
+HCl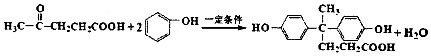 .
.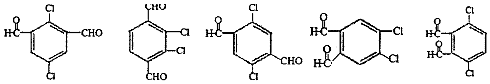 (其中两种).
(其中两种). .
.