题目内容
【题目】已经298K、101kPa时,下列说法不正确的是
反应1:4Fe(s)+3O2(g) = 2Fe2O3 (s) ΔH1 =-1648 kJ/mol
反应2:C(s) + O2 (g) = CO2 (g) ΔH2 = -393 kJ/mol
反应3:2Fe(s)+2C(s) +3O2(g) = 2FeCO3(s) ΔH3 =-1480 kJ/mol
反应4:2FeCO3(s) +1/2O2(g) =2CO2(g) +Fe2O3(s) ΔH4
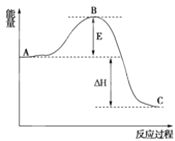
A. 上述反应1.2.3.4在热力学上自发趋势都很大
B. 反应1和3在较低温度下能自发反应,反应4是熵增反应
C. 自发反应代表反应一定能发生,可以判断过程的方向,但不能确定过程发生的速率
D. 反应1表示铁在氧气中燃烧的热化学方程式
【答案】CD
【解析】
根据盖斯定律知,反应4=反应1×![]() +反应2×2-反应3=(-1 648×
+反应2×2-反应3=(-1 648×![]() -393×2+1480) kJ·mol-1=-130 kJ·mol-1,反应1、2、3、4均为放热反应,以此分析解答。
-393×2+1480) kJ·mol-1=-130 kJ·mol-1,反应1、2、3、4均为放热反应,以此分析解答。
A.题述反应1、2、3、4都是放热反应且放出的热量较多,在热力学上自发趋势很大,故A项正确;
B.反应1和3都是放热的熵减反应,根据复合判据ΔH-T·ΔS<0知,在较低温度下能自发进行,反应4是气体分子数增大的反应,它是熵增反应,B项正确;
C. 化学反应的自发性只能判断过程的方向,不能确定反应是否一定会发生和过程发生的速率,故C项错误;
D.铁在氧气中燃烧只生成四氧化三铁,不是氧化铁,故D项错误。
故选CD。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应 2SO2(g) + O2(g)![]() 2SO3(g)(正反应放热),相关数据如下,下列说法正确的是( )
2SO3(g)(正反应放热),相关数据如下,下列说法正确的是( )
容器 1 | 容器 2 | 容器 3 | |
反应温度 T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、 1molO2 | 4molSO3 | 2molSO2、 1molO2 |
平衡ν正(SO2 )/mol·L-1·s-1 | ν1 | ν2 | ν3 |
平衡 c(SO3 )/ mol·L-1 | c1 | c2 | c3 |
平衡体系总压强 p/Pa | p1 | p2 | p3 |
物质的平衡转化率ɑ | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数 K | K1 | K2 | K3 |
A. ν1<ν2,c2<2c1 B. K1>K3,p2>2p3
C. ν1< ν3,α1(SO2) > α3(SO2) D. c2>2c3,α2(SO3) +α3(SO2)<1