题目内容
【题目】a、在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
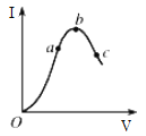
(1)“O”点导电能力为0的理由是_________________________。
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为____________。
(3)a、b、c三点处,电离程度最大的是________。
(4)若将c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施是:
①_______________________________________________;
②_______________________________________________;
③_______________________________________________。
b、反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答:
(5)增Fe的量,其正反应速率_____(填“增大”、“不变”或“减小”),平衡______(填“不”“向正反应方向“或“向逆反应方向”)移动。
(6)将容器的体积缩小一半,其正反应速率_______,平衡_______移动。
(7)保持体积不变,充入N2使体系压强增大,其正反应速率_______,平衡_______移动。
(8)保持体积不变,充入水蒸气,其正反应速率_______,平衡_______移动。
【答案】在“O”点处醋酸未电离,无离子存在 c<a<b c 加少量NaOH固体 加少量Na2CO3固体 加入Zn、Mg等金属 不变 不 增大 不 不变 不 增大 向正反应方向
【解析】
(1)根据溶液中有自由移动的离子才能导电分析,冰醋酸为纯醋酸,不存在电离,不能导电分析;
(2)根据离子浓度越大,导电能力越强分析;
(3)根据越稀越电离分析;
(4)醋酸根离子浓度增大,氢离子浓度减小,可以加入消耗氢离子的物质,使平衡正向移动,如氢氧化钠或碳酸钠或活泼金属或碳酸氢钠等;
(5)根据固体的量不影响速率和平衡分析;
(6)根据浓度增大,速率加快,但反应前后气体物质的量相等,压强增大,平衡不移动分析;
(7)根据反应体系物质的浓度不变分析速率和平衡的移动;
(8) 根据反应物的浓度增大,正反应速率加快,平衡正向移动分析。
(1)冰醋酸为纯醋酸,不存在电离,在“O”点处醋酸未电离,无离子存在,导电能力为0;
(2)离子浓度越大,导电能力越强,所以氢离子浓度关系为: c<a<b;
(3)根据越稀越电离分析,电离程度最大的为: c;
(4)醋酸根离子浓度增大,氢离子浓度减小,可以加入消耗氢离子的物质,如氢氧化钠或碳酸钠或活泼金属或碳酸氢钠等;
(5)增加铁的量不影响反应速率,平衡不移动;
(6)容器体积缩小一半,压强增大,速率增大,平衡不移动;
(7) 保持体积不变,充入N2使体系压强增大,由于物质的浓度不变,其正反应速不变,平衡不移动;
(8) 保持体积不变,充入水蒸气,增大反应物的浓度,正反应速率增大,平衡向正反应方向移动。