题目内容
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
| A.自来水 | B.0.5 mol·L-1盐酸 | C.0.5 mol·L-1CH3COOH溶液 | D.0.5 mol·L-1 KCl溶液 |
B
解析试题分析:电解质放入水中产生自由移动的离子,自由移动的离子浓度增大,使溶液的导电能力增强。如果溶液的导电能力变化小说明离子的浓度变化较小。A.水是若电解质,自由移动的离子很少,当加入氢氧化钠后,自由移动的离子浓度增大,导电能力增强。B.加入氢氧化钠与盐酸恰好反应得到氯化钠和水,消耗的氢离子的数目就、与增加的钠离子数目相等。故自由移动的离子浓度基本不变。所以溶液的导电能力基本没变化。C.醋酸是弱酸,电离产生的离子浓度较小,加入的氢氧化钠与醋酸恰好反应得到强电解质,电离产生大量的自由移动的离子。自由移动的离子浓度增大,使溶液的导电能力显著增强。D.二者不反应,自由移动的离子浓度增大,使溶液的导电能力增强。增强选项为:B.
考点:考查溶液的导电性与电解质及离子浓度的关系。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列离子方程式中正确的是
| A.乙醇和金属钠反应:2CH3CH2OH+2Na →2CH3CH2O-+ Na++H2↑ |
B.氯乙烷在NaOH醇溶液中加热:CH3CH2Cl + OH-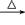 CH3CH2OH+Cl- CH3CH2OH+Cl- |
| C.苯酚与NaOH溶液中和反应:H+ + OH- = H2O |
D.苯酚钠溶液中通入少量CO2: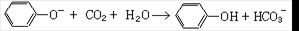 |
不能用H+ + OH- = H2O离子方程式表示的化学反应是
| A.盐酸和氢氧化钾溶液的反应 | B.硝酸和氢氧化铜溶液的反应 |
| C.盐酸和澄清石灰水的反应 | D.硫酸和氢氧化钠溶液反应 |
无色透明溶液中,可以大量共存的是
| A.Ca2+、Na+、NO3-、SO42- | B.HCO3-、Na+、Cl-、H+ |
| C.Mg2+、Cl-、Cu2+、SO42- | D.K+、Ba2+、Cl-、NO3- |
有下列物质:①石墨 ②铜丝 ③氧气 ④二氧化碳 ⑤食盐 ⑥H2SO4 ⑦水 ⑧硫酸钡 ⑨金刚石,以下组合正确的是
| A.能导电的有①②⑤⑦ | B.属于电解质的有④⑤⑥⑦⑧ |
| C.属于强电解质的有⑤⑧⑨ | D.既不属于电解质又不属于非电解质的有①②③⑨ |
除去NaCl溶液中的SO42-离子,依次加入的溶液顺序正确的是
| A.Na2CO3、HCl、 BaCl2 | B.BaCl2、HCl、Na2CO3 |
| C.Na2CO3、BaCl2、HCl | D.BaCl2、Na2CO3、HCl |
下列对对应现象的描述与离子方程式都正确的是( )
| A.金属镁与稀盐酸反应:有气体生成,Mg+2H++2Cl-=MgCl2+H2↑ |
| B.氯化钡溶液与硫酸反应:有白色沉淀生成:SO42-+Ba2+ =BaSO4↓ |
| C.碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2H+=2Na++CO2↑+H2O |
| D.过量铁粉与氯化铜溶液反应:溶液南蓝色变成浅绿色,同时有红色固体生成:Fe+Cu2+=Fe3++Cu |
 ,Na+,HSO
,Na+,HSO ,PO
,PO ,MnO
,MnO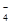
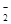 ,NO
,NO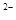 ,SO
,SO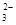
 ,CO
,CO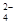 ,Cl
,Cl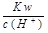 ="0.1" mol/L的溶液中:Na+,K+,SO
="0.1" mol/L的溶液中:Na+,K+,SO