题目内容
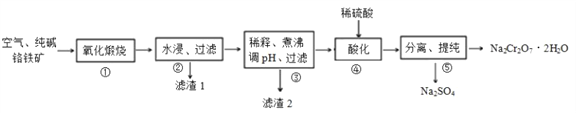
【题目】我国目前大多数工厂以铬铁矿(主要成份为 FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。 步骤①中涉及的主要反应是:
4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2。
回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为 ______, 氧化煅烧时将铬铁矿粉碎的目的是 ____________。
(2)①中杂质 Al2O3 与纯碱反应转变为可溶性盐,写出 Al2O3与纯碱反应的化学方程式________,滤渣1的主要成分为MgO和_______( 填化学式) 。
(3)滤渣2的成分是___________( 填化学式) 。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,发生反应的离子方程式为__________。
(5)该工艺的酸性废液中含有Cr2O72-,向废液中加入绿矾(FeSO4·7H2O)还原处理,反应的离子方程式是__________; 再向处理后的溶液中加入石灰水,使 c(Cr3+)降至10-5mol/L, 此时溶液的pH值为 ______(已知:该条件下,Ksp[Cr(OH)3]=1.0×10-32)。
【答案】 +6 价 增大接触面积,加快铬铁矿煅烧速率 Al2O3+ Na2CO3 ![]() 2NaAlO2+ CO2↑ Fe2O3 Al(OH)3 2H+ +2CrO42-= 2H2O + Cr2O72- Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O 5
2NaAlO2+ CO2↑ Fe2O3 Al(OH)3 2H+ +2CrO42-= 2H2O + Cr2O72- Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O 5
【解析】铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的PH,使偏铝酸盐完全沉淀,继续调节溶液的PH使CrO42-转化为Cr2O72-。
(1)由化合价代数和为0,设Cr的化合价为x,2+2x-7×2=0,二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为+6价;氧化煅烧时将铬铁矿粉碎的目的是:增大接触面积,加快铬铁矿煅烧速率;
(2)Al2O3与纯碱反应的化学方程式Al2O3+ Na2CO3 ![]() 2NaAlO2+ CO2↑;滤渣1的主要成分为MgO和Fe2O3 (3)NaAlO2,调节溶液的PH,使偏铝酸盐完全沉淀,滤渣2的成分是 Al(OH)3 ;(4)再加H2SO4溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,离子方程2H+ +2CrO42-= 2H2O + Cr2O72- ;(5)Cr2O72-具有强氧化性,用Fe2+ 将其还原, Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O (6)Ksp[Cr(OH)3]=1.0×10-32=c(Cr3+ )C(OH― )3=10-5mol/L,C(OH― )3,C(OH― )=10-9mol/L,PH=5。
2NaAlO2+ CO2↑;滤渣1的主要成分为MgO和Fe2O3 (3)NaAlO2,调节溶液的PH,使偏铝酸盐完全沉淀,滤渣2的成分是 Al(OH)3 ;(4)再加H2SO4溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,离子方程2H+ +2CrO42-= 2H2O + Cr2O72- ;(5)Cr2O72-具有强氧化性,用Fe2+ 将其还原, Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3++ 7H2O (6)Ksp[Cr(OH)3]=1.0×10-32=c(Cr3+ )C(OH― )3=10-5mol/L,C(OH― )3,C(OH― )=10-9mol/L,PH=5。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案