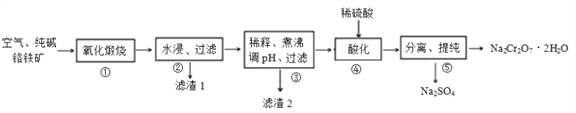
��Ŀ����
����Ŀ��I������������ֵ����Ϊ25��ʱ��
��1��ijŨ�ȵ�NH3��H2O��Һ�У���ˮ�����c(H+)=1��10-12mol/L,����Һ�� pH=_________
��2����pH=3��H2SO4 ��Һ��pH=12��NaOH��Һ���, ��Ϻ�������Һ��PH=10����H2SO4 ��Һ��NaOH��Һ�������Ϊ______________
��3����0.02mol/L��MgCl2��Һ�м���NaOH���壬��Ҫ����Mg(OH)2��������Һ��pH���Ϊ__________����֪Ksp[Mg(OH)2]=3.2��10-11,lg2.5=0.4��
II����1���μ���϶��![]() ��ʹ�������ʼ��ԣ�����������������ͨ��ʩ������ʯ���ĩ����Ҫ����CaSO4������ˮ�������������ļ��ԡ�д���ù����з�����Ӧ�Ļ�ѧ����ʽ_______________________________
��ʹ�������ʼ��ԣ�����������������ͨ��ʩ������ʯ���ĩ����Ҫ����CaSO4������ˮ�������������ļ��ԡ�д���ù����з�����Ӧ�Ļ�ѧ����ʽ_______________________________
��2��![]() ��һ����ɫ��ɫҺ�壬��ˮ���ҷ�Ӧ�õ�����������Ȼ��⣬��һ�ֳ��õ���ˮ������
��һ����ɫ��ɫҺ�壬��ˮ���ҷ�Ӧ�õ�����������Ȼ��⣬��һ�ֳ��õ���ˮ������![]() ��
��![]() ��ϲ����ȣ��ɵõ���ˮ
��ϲ����ȣ��ɵõ���ˮ![]() ���õ���ˮ
���õ���ˮ![]() �Ļ�ѧ����ʽΪ______________________________
�Ļ�ѧ����ʽΪ______________________________
���𰸡�129��19.6Na2CO3+CaSO4�TNa2SO4+CaCO3FeCl36H2O+6SOCl2=FeCl3+6SO2��+12HCl��
�����������������I����1����ˮ������ˮ�ĵ��룬��ˮ����������ˮ����ģ��ݴ˼����pH��
��2�����ж����������⣬������pH=-lg(H+)���㣻
��3�������ܶȻ��������㣻
II����1������ˮ��ԭ�����������������ˮ���Ӱ�������
��2��SOCl2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������á�
��������1��ijŨ�ȵ�NH3H2O��Һ�е���������ˮ����ģ�Ҳ����Һ��������Ũ�ȣ�����Һ��(H+)=1��10-12mol/L������Һ��pH=12��
��2��pH=-lg(H+)��pH=12������������Һ��(H+)=1��10-12mol/L��c(OH-)=0.01mol/L��pH=3��H2SO4 ��Һ��������Ũ�ȣ���c(OH-)=(0.01mol/L��V��0.001mol/L��V��)/(V��+V��)
=0.0001mol/L����ã�V����V��=9��1��
��3��Ksp[Mg(OH)2]=c(Mg2+)��c2(OH-)=3.2��10-11�������Һ��Qc��Ksp[Mg(OH)2]���ܲ���������c(OH-)=![]() =4��10-5 mol/L����(H+)=2.5��10-10mol/L������pH=9.6��
=4��10-5 mol/L����(H+)=2.5��10-10mol/L������pH=9.6��
II����1���������ˮ���Լ��ԣ������μ�ز������ԣ�ˮ�����ӷ�ӦΪCO32-+H2O![]() HCO3-+OH-��ʯ������̼������ӷ�Ӧ��ƽ�������ƶ���OH-Ũ�Ƚ��ͣ����ͼ��ԣ�ʯ��������Ca2+��CO32-������ɸ����ܵ�CaCO3 ����Ӧ����ʽΪ��Na2CO3+CaSO4��Na2SO4+CaCO3��
HCO3-+OH-��ʯ������̼������ӷ�Ӧ��ƽ�������ƶ���OH-Ũ�Ƚ��ͣ����ͼ��ԣ�ʯ��������Ca2+��CO32-������ɸ����ܵ�CaCO3 ����Ӧ����ʽΪ��Na2CO3+CaSO4��Na2SO4+CaCO3��
��2��ʹSOCl2��FeCl36H2O��ϲ����ȣ��ɵõ���ˮFeCl3��SOCl2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã���Ӧ�Ļ�ѧ����ʽΪ��FeCl36H2O+6SOCl2��FeCl3+6SO2��+12HCl����

����Ŀ��һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ�
��.�������з�Ӧ���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�����
Ni��s����4CO��g��![]() Ni��CO��4��g�� �÷�Ӧ�Ħ�H_______0��ѡ�����������������
Ni��CO��4��g�� �÷�Ӧ�Ħ�H_______0��ѡ�����������������
��.�ڸ�����һ����̼�ɽ���������ԭΪ��������֪��
C��s����O2��g����CO2��g������H1����393.5 kJ��mol��1
CO2��g����C��s����2CO��g������H2��+172.5 kJ��mol��1
S��s����O2��g����SO2��g������H3����296.0 kJ��mol��1
��2CO��g����SO2��g����S��s����2CO2��g�� ��H4��________��
��.��ҵ��һ�����CO��H2��Ӧ�ϳɿ�������Դ�״�����Ӧ����:
CO��g��+2H2��g��![]() CH3OH��g��
CH3OH��g��
ij�¶��£�����molCO�ͣ�molH2���룲L���ܱ������У���ַ�Ӧ�ﵽƽ���
��c��CO��=0.2mol��L��1����CO��ת����Ϊ___________��
�ϳ�����ѹ�����º����10m3�״��ϳ������ڴ��������£�ͨ����Ӧ���м״��ϳɣ�T1���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���һ����CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH |
Ũ��/��mol��L��1�� | 0.2 | 0.1 | 0.4 |
�Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v��_______v�� ���>������<�����������������������䣬��T2�淴Ӧ10min��ﵽƽ�⣬c��H2����0.4 mol��L��1�����ʱ���ڷ�Ӧ���ʣ�
v��CH3OH�� ��__________��
��4�����������ﱻһ����̼��ԭ���ɽ������ʺͶ�����̼����ͼ�����ֽ��������ﱻһ����̼��ԭʱlg[c��CO��/c��CO2��]���¶ȣ�t���Ĺ�ϵ����ͼ��800��ʱ���������ױ���ԭ�Ľ�����������____���ѧʽ�����÷�Ӧ��ƽ�ⳣ����ֵ��K������____________��