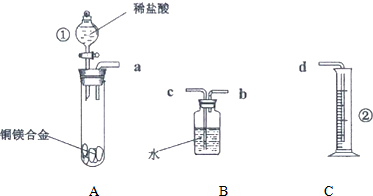
题目内容
16.在有酸参与的下列反应中,参加反应的酸既表现酸性又表现还原性的是( )| A. | 2Na+2HCl═2NaCl+H2↑ | |
| B. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| C. | CuO+H2SO4═CuSO4+H2O | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
分析 反应中酸既体现酸性又体现还原性,说明该反应中有电子转移,且部分酸的化合价不变、部分化合价降低,以此解答该题.
解答 解:A.该反应中HCl中H元素化合价由+1价变为0价,所以HCl作氧化剂,故A错误;
B.反应中S元素化合价降低,浓硫酸表现为氧化性,故B错误;
C.该反应中各元素化合价不变,不属于氧化还原反应,属于复分解反应,故C错误;
D.该反应中部分Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以HCl 既体现酸性又体现还原性,故D正确.
故选D.
点评 本题考查了氧化还原反应,根据元素化合价变化结合基本概念分析判断,了解常见元素化合价,题目难度不大.

练习册系列答案
相关题目
5.从节约原料,保护环境的角度来分析,要制取一定量的硝酸铜晶体,下列实验设计中最合理的是( )
| A. | Cu与4HNO3(浓)反应 | |
| B. | Cu与8HNO3(稀)反应 | |
| C. | Cu在空气加热后生成CuO,再将CuO与硝酸反应 | |
| D. | Cu在氯气加热后生成CuCl2,再将CuCl2溶于硝酸 |







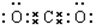
 .
.