��Ŀ����
����Ŀ�������������ܣ����γɵ�һ�������1Co��NH3��5NO2]Cl2���Ʊ�������ͼ�� ![]()
��1��Co2+��̬��������Ų�ʽΪ ��
��2�������1Co��NH3��5Cl]Cl2����Co3+�γ���λ����ԭ��Ϊ����Ԫ�ط��ţ��������� 1Co��NH3��5NO2]2+�������е�ԭ�ӵ��ӻ��������Ϊ ��
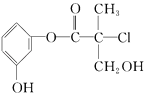
��3����NO2����Ϊ�ȵ�����ĵ��ʷ���Ϊ��д��ѧʽ����
��4��H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ ��
��5������������ˮ���п�ת��Ϊǿ�°�����������������NDMA�Ľṹ��ʽ��ͼ ![]() ��ʾ��1molNDMA�����к��ЦҼ�����ĿΪmol��
��ʾ��1molNDMA�����к��ЦҼ�����ĿΪmol��
���𰸡�
��1��[Ar]3d7��1s22s22p63s23p63d7
��2��N��Cl��sp2��sp3
��3��O3
��4��H2O2��H2O֮������γ����
��5��10
���������⣺��1��Co2+����25�����ӣ���̬��������Ų�ʽΪ[Ar]3d7��1s22s22p63s23p63d7 �� ���Դ��ǣ�[Ar]3d7��1s22s22p63s23p63d7��
2�������1Co��NH3��5Cl]Cl2�е����������ṩ�¶Ե��Ӷ���Co3+�γ���λ����Co��NH3��5NO2]2+��������NH3�е�ԭ�ӵ��ӻ��������Ϊsp3 �� ��NO2���е�ԭ�ӵ��ӻ��������Ϊsp2 �� ���Դ��ǣ�N��Cl��sp2��sp3��
3��NO2���ĵ�����Ϊ24����ȵ�����ΪO3 �� ���Դ��ǣ�O3��
4��H2O2��H2O֮������γ�������ܽ��������H2O2��H2O��������������ܣ����Դ��ǣ�H2O2��H2O֮������γ������
5��˫����һ���м���һ���Ҽ���1molNDMA�С��ṹ��ʽ��ͼ ![]() ����6molC��H��2molC��N��1molN��N��1molN��O�Ҽ�����10mol�Ҽ������Դ��ǣ�10��
����6molC��H��2molC��N��1molN��N��1molN��O�Ҽ�����10mol�Ҽ������Դ��ǣ�10��

 �߽�������ϵ�д�
�߽�������ϵ�д�����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�أ�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ������ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��Wλ�����ڱ��е����ڣ����壻
��2��X���γ�˫ԭ�ӷ��ӣ�����ӵĵ���ʽ����Y����Ԫ���γɵ�10�������г�����+1��������Ϊ���ѧʽ����ͬ����Z����Ԫ���γɵ�18�������г����ĩ�1��������Ϊ��
��3����ҵ�Ͻ������W����ͨ�����ڵ�Z�����п��Ƶû�����Z2W2 �� �����ʿ���ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬д��Z2W2��ˮ��Ӧ�Ļ�ѧ����ʽ
��4����һ�������£���Ԫ��Y��Z��ɵ�һ����̬������ɷ�����������Ӧ����Ӧ��ƽ�����������̬���ʹ��棬��֪ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��