题目内容
【题目】根据题意解答
(1)9.8gH2SO4的物质的量是;2.0molH2O的质量是 .
(2)含Al3+5.4g的硫酸铝的物质的量为 , 其中含SO42﹣个.
(3)某二价金属1.6g在氧气中完全燃烧生成2g氧化物,则该金属的相对原子量 .
(4)6.02×1023个CO2与molH2质量相等,与gSO2含有的氧原子数相等.
【答案】
(1)0.1mol;36g
(2)0.1mol;0.3NA
(3)64
(4)22;64
【解析】解:(1)9.8gH2SO4的物质的量为: ![]() =0.1mol;2.0molH2O的质量是:18g/mol×2.0mol=36g, 所以答案是:0.1mol;36g;(2)5.gAl3+5的物质的量为:
=0.1mol;2.0molH2O的质量是:18g/mol×2.0mol=36g, 所以答案是:0.1mol;36g;(2)5.gAl3+5的物质的量为: ![]() =0.2mol,该硫酸铝的物质的量为:0.2mol×
=0.2mol,该硫酸铝的物质的量为:0.2mol× ![]() =0.1mol,其中含SO42﹣ 的物质的量为:0.1mol×3=0.3mol,含有硫酸根离子的数目为0.3NA ,
=0.1mol,其中含SO42﹣ 的物质的量为:0.1mol×3=0.3mol,含有硫酸根离子的数目为0.3NA ,
所以答案是:0.1mol;0.3NA;(3)某二价金属1.6g在氧气中完全燃烧生成2g氧化物,设该氧化物的化学式为RO,反应消耗O原子的质量为:2g﹣1.6g=0.4g,消耗O的物质的量为: ![]() =
= ![]() mol,该金属原子的摩尔质量为:
mol,该金属原子的摩尔质量为: 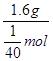 64g/mol,其相对原子量为64,
64g/mol,其相对原子量为64,
所以答案是:64;(4)6.02×1023个CO2的物质的量为: ![]() =1mol,其质量为:44g/mol×1mol=44g,质量相等时需要氢气的物质的量为:
=1mol,其质量为:44g/mol×1mol=44g,质量相等时需要氢气的物质的量为: ![]() =22mol;1mol二氧化碳分子中含有2molO原子,含有氧原子相同时需要二氧化碳的物质的量为1mol,质量为:64g/mol×1mol=64g,
=22mol;1mol二氧化碳分子中含有2molO原子,含有氧原子相同时需要二氧化碳的物质的量为1mol,质量为:64g/mol×1mol=64g,
所以答案是:22;64.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

