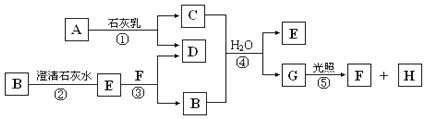
题目内容
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
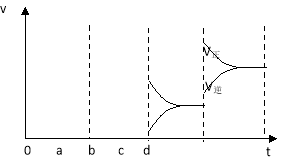
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.
2SO3 △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速率变化情况画在c~d处.

【答案】(1)2mol/(L·min);1mol/(L·min); 2mol/L
(2)升温;减小 SO3 浓度;
【解析】
试题分析:(1)2min内SO2的浓度由6mol/L下降为2mol/L,二氧化硫的反应速率为:v(SO2)=(6-2)mol/L/2min=2mol/(L*min),用O2浓度变化来表示的反应速率为:v(O2)=1/2*2mol/(L*min)=1mol/(L*min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L*min),二氧化硫的反应速率为:v(SO2)=2v(O2)=2*0.5mol/(L*min)=1mol/(L*min),反应消耗的二氧化硫的物质的量浓度为:n()=1mol/(L*min)*2min=2mol/L,则2min时SO2的浓度为:4mol/L-2mol/L=2mol/L,
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为: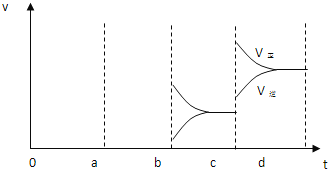 ,
,
因此,本题正确答案是:升高温度;减小SO3浓度;