题目内容
【题目】化学反应原理在工业生产中具有十分重要的意义。
工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
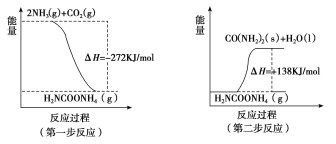
(1)则NH3 (g)与CO2(g)反应生成尿素的热化学方程式为______________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH =a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH =a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1. 00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v (CO)为__________________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有____________________。
(3) 利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_______________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2 (标准状况下),电解后溶液的pH=_______(溶液电解前后体积的变化忽略不计)。

【答案】 (1)2NH3(g)+CO2(g)![]() H2O(l)+H2NCONH2(s) △H =-134kJmol-1 (2分)
H2O(l)+H2NCONH2(s) △H =-134kJmol-1 (2分)
(2)①K =c(CO)/c(CO2) (1分); > (1分); 50% (1分) 0.2mol/(Lmin) (1分)
②增加 CO2 的量、升高温度 (2分)
(3)CH3OH-6e-+H2O![]() CO2+6H+ (2分) ; 1 (2分)
CO2+6H+ (2分) ; 1 (2分)
【解析】 (1)第一步反应的热化学方程式为:2NH3(g)+CO2(g)![]() H2NCOONH4(g) △H =-272kJmol-1 ,第二步反应的热化学方程式为: H2NCOONH4(g)
H2NCOONH4(g) △H =-272kJmol-1 ,第二步反应的热化学方程式为: H2NCOONH4(g) ![]() CO(NH2)2+ H2O(l)
CO(NH2)2+ H2O(l)
△H =+138kJmol-1,上述两步反应相加,NH3 (g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)![]() H2O(l)+H2NCONH2(s) △H =-134kJmol-1;
H2O(l)+H2NCONH2(s) △H =-134kJmol-1;
(2)①平衡常数表达式为:K =c(CO)/c(CO2) ;由于温度升高平衡常数增大,反应为吸热反应,a > 0;500 ℃时该反应的平衡常数为1,转化的 CO2为2mol,CO2的转化率为50% ,生成CO的平均速率v (CO)=2/(2×5)=0.2mol/(Lmin);
② 700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有增加 CO2 的量或升高温度 ;
(3) “甲醇-空气”形成的绿色燃料电池的正极是O2,负极是CH3OH,有质子交换膜是酸性电池,CH3OH 被氧化为CO2,根据化合价、电子守恒、电荷守恒,负极的电极反应式CH3OH-6e-+H2O![]() CO2+6H+;利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2 (标准状况下),转移电子数为(0.56/22.4)×4=1mole-,生成H+1mol,c(H+)=1mol/L,pH=1。
CO2+6H+;利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2 (标准状况下),转移电子数为(0.56/22.4)×4=1mole-,生成H+1mol,c(H+)=1mol/L,pH=1。