题目内容
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO。下列叙述正确的是
Si3N4+6CO。下列叙述正确的是
| A.Si3N4的摩尔质量是154g |
| B.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂 |
| C.Si3N4既是氧化产物,又是还原产物 |
| D.1molSiO2发生反应,N2得到4mol电子 |
D
解析试题分析:A.摩尔质量的单位是g/mol.错误。B.在氮化硅的合成反应中,N2中的N元素的化合价降低,得到电子,是氧化剂,而单质C中的C元素的化合价升高,失去电子,是还原剂。错误。C.由于在反应中N2→Si3N4,N元素的化合价降低得到电子。而Si的化合价没有变化,所以Si3N4是还原产物。错误。D.由方程式可以看出若有3mol的SiO2发生反应。转移电子12mol.因此1molSiO2发生反应,N2得到4mol电子。正确。
考点:考查氧化还原反应的概念、化合价的升降及电子转移的知识。

下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42— |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是
| A.上述反应中,每消耗2mol NO2,就会生成22.4L N2O |
| B.N2O有氧化性,且为HNO2的酸酐 |
| C.等质量的N2O和CO2含有相等的电子数 |
| D.N2O会迅速与人体血红蛋白结合,使人中毒 |
下列说法正确的是
| A.强氧化剂与强还原剂不一定能发生氧化还原反应 |
| B.含最高价元素的化合物一定只表现强氧化性 |
| C.阳离子只有氧化性,阴离子只有还原性 |
| D.发生化学反应时,失电子越多的金属原子,还原能力越强 |
常温常压下过氧化钠可与CO2反应,与CO不反应。现将CO2、CO的混合气体在一定条件下和足量过氧化钠充分反应后,若固体质量增加了28 g,下列说法正确的是
| A.反应过程中,电子转移数为2NA |
| B.固体生成物的质量为106 g |
| C.CO可能有剩余 |
| D.反应后一定生成11.2 L氧气 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和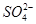 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
| A.9.0 L | B.13.5 L | C.15.7 L | D.16.8 L |
下列说法正确的是( )。
| A.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 |
| B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是3∶4 |
| C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
| D.从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应 |
将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,则下列叙述中错误的是( )
| A.反应中消耗的Zn的质量为97.5 g |
| B.气体A中SO2和H2的体积比为1∶4 |
| C.反应中被还原的元素只有一种 |
| D.反应中共转移电子3 mol |