题目内容
9.过氧化氢有广泛的用途.有“绿色氧化剂”美称.I.工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其流程如下:
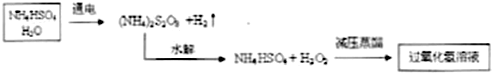
(1)根据上述反应原理,写出电解硫酸氢铵溶液时阳极的电极反应方程式2SO42--2e-=S2O82-.
(2)在以上流程图中,采用减压蒸馏的原因是双氧水不稳定,受热容易分解,减小压强,使液体的沸点降低.
II.(1)保存过氧化氢试剂瓶上最适合贴上的标签是B.(填序号)
(2)H2O2可用于消除采矿业胶液中的氰化物,如KCN;KCN+H2O2+H2O=A+NH3↑,生成物A的化学式是KHCO3.
(3)某同学做实验时,误把H2O2溶液当作酸与Fe2O3粉末混合,发现有大量气泡产生.
[提出问题]MnO2可作为H2O2分解的催化剂,Fe2O3是否也能作为H2O2分解的催化剂?
[猜想]Fe2O3能作为H2O2分解的催化剂.
[设计实验验证]
实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,说明H2O2在常温下能缓慢分解.
实验二:在实验一的试管中加入wgFe2O3粉末,有大量气泡产生,伸入带火星的木条,木条复燃,说明氧化铁能加快氧气的产生速率.
实验三:待反应结束后,将试管中的不溶物滤出,洗涤、干燥,称量,固体质量仍为wg,说明氧化铁在反应前后质量没有变化.
[结论]Fe2O3粉末可作为H2O2分解的催化剂.
[反思与评价]①有同学认为,还需要再做一个实验,以验证反应后氧化铁的化学性质没有改变,才能证明上述结论正确.
②某同学做了以下对照试验,测定用足量H2O2溶液制取相同体积O2所需的时间,得到下表数据.通过分析数据,可得出结论相同条件下,二氧化锰的催化效果比氧化铁好,其它条件相同时,双氧水的浓度越大,产生氧气的速率越快.
| 浓度 时间(min) 催化剂 | 30% H2O2溶液 | 15% H2O2溶液 | 5% H2O2溶液 |
| 加入WgMnO2 | 0.2 | 0.8 | 2.0 |
| 加入MgFe2O3 | 7.0 | 9.0 | 16.0 |
分析 Ⅰ(1)根据题中流程,电解硫酸氢铵水溶液得(NH4)S2O8和氢气,根据化合价升降可知,阳极的电极反应为SO42-被氧化成S2O82-;
(2)双氧水不稳定,受热容易分解,所以要得到过氧化氢溶液,就要减小压强,使液体的沸点降低;
Ⅱ(1)过氧化氢是具有强氧化性的试剂,据此贴标签;
(2)根据KCN+H2O2+H2O=A+NH3↑,利用元素守恒可知生成物A的化学式;
(3)实验二:能使带火星的木条复燃的气体应为氧气;
实验三:催剂能改变化学反应速率,但自身的化学性质和质量都保持不变,据此答题;
[反思与评价]①实验三证明了氧化铁的质量不变,但要证明氧化铁是催化剂还要证明氧化铁的化学性质没有变;
②根据表中的数据可知,该对照试验比较了不同催化剂以及同一种催化剂在双氧水浓度不同时产生氧气的快慢;
解答 解:Ⅰ(1)根据题中流程,电解硫酸氢铵水溶液得(NH4)S2O8和氢气,根据化合价升降可知,阳极的电极反应为SO42-被氧化成S2O82-,阳极的电极反应方程式为2SO42--2e-=S2O82-,
故答案为:2SO42--2e-=S2O82-;
(2)双氧水不稳定,受热容易分解,所以要得到过氧化氢溶液,就要减小压强,使液体的沸点降低,
故答案为:双氧水不稳定,受热容易分解,减小压强,使液体的沸点降低;
Ⅱ(1)过氧化氢是具有强氧化性的试剂,
故选B;
(2)根据KCN+H2O2+H2O=A+NH3↑,利用元素守恒可知生成物A的化学式为KHCO3,
故答案为:KHCO3;
(3)实验二:能使带火星的木条复燃的气体应为氧气,所以可以说明氧化铁能加快氧气的产生速率,
故答案为:氧化铁能加快氧气的产生速率;
实验三:说明氧化铁在反应前后质量没有变化,
故答案为:氧化铁在反应前后质量没有变化;
[反思与评价]①实验三证明了氧化铁的质量不变,但要证明氧化铁是催化剂还要证明氧化铁的化学性质没有变,所以还需要做的实验是反应后氧化铁的化学性质没有改变,
故答案为:反应后氧化铁的化学性质没有改变;
②根据表中的数据可知,该对照试验比较了不同催化剂以及同一种催化剂在双氧水浓度不同时产生氧气的快慢,根据数据得到的结论是相同条件下,二氧化锰的催化效果比氧化铁好,其它条件相同时,双氧水的浓度越大,产生氧气的速率越快,
故答案为:相同条件下,二氧化锰的催化效果比氧化铁好,其它条件相同时,双氧水的浓度越大,产生氧气的速率越快.
点评 本题考查了电化学、实验基本操作、实验方案的设计和分析等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.

 阅读快车系列答案
阅读快车系列答案| A. | 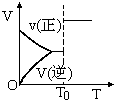 aX(g)+bY(g)?cZ(g)密闭容器中反应达平衡,T0时条件改变如图所示,则改变的条件一定是加入催化剂 | |
| B. |  L(s)+aG(g)?bR(g)反应达到平衡时,外界条件对平衡影响如图所示,若P1>P2,则a>b | |
| C. | 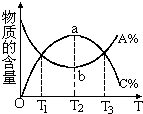 aA+bB?cC物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应 | |
| D. | 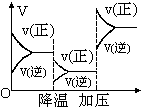 A+2B?2C+3D反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
| A. | pH=2.5 | B. | pH=1.5 | C. | pH=12.5 | D. | pH=11.5 |
As2O3+Zn+H2SO4-→AsH3+ZnSO4+H2O,As2O3在上述反应中显示出来的性质是 ( )
| A. | 氧化性 | B. | 还原性 | C. | 酸性 | D. | 碱性 |
| A. | 氧化剂是MnO2 还原剂是HCl | |
| B. | 每生成1 molCl2,转移电子的物质的量是2 mol | |
| C. | 每消耗1 mol MnO2,表现还原作用的HCl为4 mol | |
| D. | Cl2既是氧化产物,也是还原产物 |
 mol•L﹣1,则c1和c2的数值关系是( )
mol•L﹣1,则c1和c2的数值关系是( )