��Ŀ����
19��ʵ������ȡ�����ķ�ӦΪ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O������˵������ȷ���ǣ�������| A�� | ��������MnO2 ��ԭ����HCl | |
| B�� | ÿ����1 molCl2��ת�Ƶ��ӵ����ʵ�����2 mol | |
| C�� | ÿ����1 mol MnO2�����ֻ�ԭ���õ�HClΪ4 mol | |
| D�� | Cl2�����������Ҳ�ǻ�ԭ���� |
���� ��ӦMnO2+4HCl�TMnCl2+Cl2+2H2O�У�MnԪ�ػ��ϼ۽��ͣ�����ԭ��MnO2Ϊ��������ClԪ�ػ��ϼ����ߣ���������HClΪ��ԭ����Cl2Ϊ�������MnCl2Ϊ��ԭ�����ϵ���ת����Ƚ��
��� �⣺A����ӦMnO2+4HCl�TMnCl2+Cl2+2H2O�У�MnԪ�ػ��ϼ۽��ͣ�����ԭ��MnO2Ϊ��������ClԪ�ػ��ϼ����ߣ���������HClΪ��ԭ������A��ȷ��
B��ClԪ�ػ��ϼ���-1�����ߵ�0�ۣ�������1 mol Cl2ʱ��2 mol����ת�ƣ���B��ȷ��
C��ÿ����1molMnO2������4moLHCl������ֻ�ԭ���õ�HClΪ2mol����C����
D����������MnO2 ��ԭ����HCl����Cl2Ϊ�������MnCl2Ϊ��ԭ�����D����
��ѡCD��
���� ���⿼��������ԭ��Ӧ��������ѧ���ķ��������Ŀ��飬Ϊ�߿���Ƶ����ͳ������ͣ�ע���Ԫ�ػ��ϼ۵ĽǶȷ������ѶȲ���

��ϰ��ϵ�д�
 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
�����Ŀ
10������������������ν�����ʽ�Σ�����к�����Ԫ�ص��ν�����ʽ�������������ڼ�ʽ�ε��ǣ�������
| A�� | KHSO4 | B�� | Cu2��OH��2CO3 | C�� | Ca��H2PO4��2 | D�� | NH4NO3 |
11������˵���в���ȷ���ǣ�������
| A�� | �ڼס������ձ�����Һ�У�������Cu2+��K-��H+��Cl-��CO32-��OH-�������ӣ���֪���ձ�����Һ������3�����Ӳ�������ɫ�������ձ�����Һ�к��е�3�������ǣ�K+��OH-��CO32- | |
| B�� | ������pH=7����Һ�У�Fe3+��Mg2+��SO42-��Cl-�ܴ������� | |
| C�� | �ں���HCO3-��SO32-��S2-��CH3COO-���������ӵ���Һ�м���������BaO2�����CH3COO-Ũ�ȱ仯��С | |
| D�� | ������ˮ�������c��OH-��=10-10����Һ�У�Na+��ClO-��S2-��NH4+���ܴ������� |
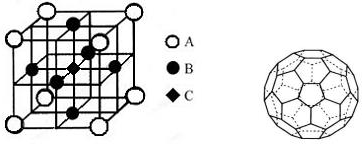
 ��֪A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ�ڶ����ڣ�A��ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����E�С����������֮�ƣ�E4+���ԭ�ӵĺ�������Ų���ͬ��A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬A��B����Ԫ����ɵ�ԭ�Ӹ���֮��Ϊ1��1�Ļ�����N�dz������л��ܼ���
��֪A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ�ڶ����ڣ�A��ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����E�С����������֮�ƣ�E4+���ԭ�ӵĺ�������Ų���ͬ��A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬A��B����Ԫ����ɵ�ԭ�Ӹ���֮��Ϊ1��1�Ļ�����N�dz������л��ܼ��� ��E�Ļ�̬ԭ�ӵ���Χ�����Ų�ʽΪ3d24s2��
��E�Ļ�̬ԭ�ӵ���Χ�����Ų�ʽΪ3d24s2��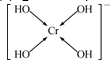 ����������λ�����ü��ű�ʾ��
����������λ�����ü��ű�ʾ��