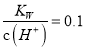题目内容
【题目】把0.8mol X 气体和0.4mol Y 气体混合于2L 密闭容器中,使它们发生如下反应:2X(g)+Y (g)n Z (g)+2W (g).2min 末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.05mol(Lmin)﹣1 , 计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度.
(3)化学反应方程式中n 值是多少?
【答案】
(1)解:把0.8molX气体和0.4molY气体混合于2L容器中,2min末已生成0.2molW,则:
3X(气)+ | Y(气) | ═ | nZ(气)+ | 2W(气) | |
起始量(mol): | 0.8 | 0.4 | 0 | 0 | |
变化量(mol): | 0.3 | 0.1 | 0.1n | 0.2 | |
2min末(mol): | 0.5 | 0.3 | 0.1n | 0.2 |
根据c= ![]() 计算c(X)=
计算c(X)= ![]() =0.075mol/(Lmin),答:前2min内用X的浓度变化表示的平均反应速率为0.075mol/(Lmin);
=0.075mol/(Lmin),答:前2min内用X的浓度变化表示的平均反应速率为0.075mol/(Lmin);
(2)解:根据三行式确定2min末时Y的浓度为: ![]() =0.15mol/L,
=0.15mol/L,
答:2min末时Y的浓度为0.15mol/L;
(3)解:以Z的浓度变化表示的反应速率为0.05mol(Lmin)﹣1= ![]() ,解得n=2.
,解得n=2.
答:化学反应方程式中n值是2.
【解析】把0.8molX气体和0.4molY气体混合于2L容器中,2min末已生成0.2molW,则:
3X(气)+ | Y(气) | ═ | nZ(气)+ | 2W(气) | |
起始量(mol): | 0.8 | 0.4 | 0 | 0 | |
变化量(mol): | 0.3 | 0.1 | 0.1n | 0.2 | |
2min末(mol): | 0.5 | 0.3 | 0.1n | 0.2 |
·(1)根据c= ![]() 计算c(X);(2)根据三行式确定2min末时Y的浓度;(3)根据速率计算生成Z的物质的量,进而计算n的值.
计算c(X);(2)根据三行式确定2min末时Y的浓度;(3)根据速率计算生成Z的物质的量,进而计算n的值.
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是:______(填具体元素符号,下同)。原子结构示意图为________________ 。元素⑦名称为_______在周期表中的位置________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的化学式是:_____________。
(3)最高价氧化物是两性氧化物的元素是__________;写出它的氧化物与氢氧化钠反应的离子方程式__________________________________________________。
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是(写元素符号)______________。
(5)元素③的氢化物的化学式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为______________________。
(6)写出⑥的最高价氧化物的水化物和①反应的化学方程式:_______________。