题目内容
【题目】(1)A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:
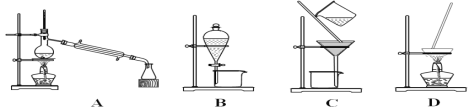
①分离植物油和水,选择装置______(填序号),主要使用仪器名称______;
②分离乙二醇和丙三醇的混合溶液,选择装置______(填序号)。
物质 | 熔点 (摄氏度) | 沸点(摄氏度) | 密度(g/cm-3) | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比例互溶 |
(2)实验室需配制250mL0.1mol·L-1的Na2CO3溶液,填空并回答下列问题:
①配制250mL0.1mol·L-1的Na2CO3溶液,实际应称取Na2CO3的质量是______g,实验过程中所需的玻璃仪器有______。
②若在溶液配制过程中出现如下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”)
若容量瓶中有少量蒸馏水__________;若定容时俯视刻度线__________。
(3)焦炭与浓硫酸加热条件下发生如下反应:C +2H2 SO4(浓)=2SO2↑+ CO2↑ +2H2O,当反应中转移2mole—时,生成SO2的体积(标准状况)是____L。
【答案】B 分液漏斗 A 2.7g 250mL容量瓶 玻璃棒 烧杯 胶头滴管 无影响 偏高 22.4
【解析】
(1)①根据植物油不溶于水分析;②根据乙二醇和丙三醇的物理性质差异分析判断;
(2)根据m=cVM计算碳酸钠的质量;根据配制过程选择需要的玻璃仪器;根据c=n/V结合实验操作分析误差;
(3)根据硫元素的化合价变化结合V=nVm计算。
(1)①植物油不溶于,则分离植物油和水可以通过分液法,则选择装置B,主要使用仪器名称为分液漏斗;
②乙二醇和丙三醇互溶,但二者的沸点相差较大,则分离乙二醇和丙三醇的混合溶液应选择蒸馏,所以选择装置A。
(2)①配制250mL0.1mol·L-1的Na2CO3溶液,需要Na2CO3的质量是0.25L×0.1mol/L×106g/mol=2.65g,因此实际应称取碳酸钠是2.7g;实验过程是计算、称量、溶解、冷却、转移、洗涤、定容和摇匀等,则其中所需的玻璃仪器有250mL容量瓶、玻璃棒、烧杯、胶头滴管。
②若容量瓶中有少量蒸馏水,由于不影响溶质的质量和溶液体积,则溶液浓度不变;若定容时俯视刻度线,导致溶液的体积减少,则浓度偏高。
(3)根据方程式可知硫元素化合价从+6价降低到+4价,转移2个电子,则当反应中转移2mole—时,生成SO2的物质的量是1mol,体积(标准状况)是22.4L。