题目内容
【题目】Fe2+、Fe3+与O![]() 、CN-、F-有机分子等形成的化合物具有广泛的应用。
、CN-、F-有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(2)Fe2+基态核外电子排布式为__________________________。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。
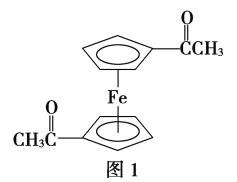
此物质中碳原子的杂化方式是______________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为___________________________。
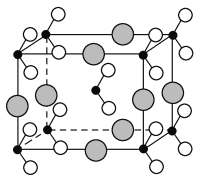
(5)F-不仅可与Fe3+形成[FeF6]3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。
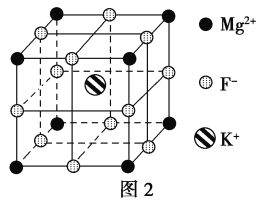
该晶体的化学式为_________________________。
【答案】(1)N>O>C (2)1s22s22p63s23p63d6(或[Ar]3d6)
(3)sp3、sp2 (4)CO(或N2) 4∶3 (5)KMgF3
【解析】(1)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于N原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能数值由大到小的顺序为N>O>C。(2)Fe是26号元素,其原子核外电子排布式为[Ar]3d64s2,Fe2+为Fe原子失去4s上2个电子,则Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6。(3)乙酰基二茂铁中甲基碳原子采用sp3杂化,羰基碳原子采用sp2杂化。(4)配合物K3Fe(CN)6的配体为CN-,C得到一个e-为N或N得到一个e-为O,所以CN-与N2或CO互为等电子体;(CN)2为直线型分子,具有对称性,其结构式为NCCN,单键为σ键,CN中含有一个σ键,2个π键,因此(CN)2中π键和σ键的个数比为4∶3。(5)根据晶胞结构可知,Mg2+、F-、K+分别位于顶点、棱心和体心处,根据均摊法可知,晶胞中含有的Mg2+、F-、K+个数分别是8×![]() =1个,12×
=1个,12×![]() =3个,1个,所以该物质的化学式为KMgF3。
=3个,1个,所以该物质的化学式为KMgF3。

 口算能手系列答案
口算能手系列答案